题目内容
3.质量分数为10%的NaOH液中Na和H2O的物质的量之比为1:21.分析 质量分数为10%的NaOH,设氢氧化钠40g,则溶剂水是360g,所以氢氧化钠的物质的量为1mol,根据钠守恒钠的物质的量为1mol,生成氢气的质量为:0.5×2=1g,所以水的质量为:400-23+1=378g,由此分析解答.
解答 解:质量分数为10%的NaOH,设氢氧化钠40g,则溶剂水是360g,所以氢氧化钠的物质的量为1mol,根据钠守恒钠的物质的量为1mol,生成氢气的质量为:0.5×2=1g,所以水的质量为:400-23+1=378g,所以水的物质的量为:$\frac{378}{18}$=21mol,则Na和H2O的物质的量之比为1:21,
故答案为:1:21.
点评 本题考查物质的量的有关计算、溶液质量分数的计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
4.下列各组离子在水溶液中能大量共存的是( )
| A. | K+、HCO3-、CO32-、Br- | B. | SO32-、HSO3-、OH-、K+ | ||
| C. | Fe3+、Cu2+、NO3-、SO32- | D. | H+、Na+、NO3-、Fe2+ |
5.下列属于盐的是( )
| A. | CO2 | B. | Ca(ClO)2 | C. | Na2O | D. | H2CO3 |
11.与氢气反应的热化学方程式是
①I2(g)+H2(g)?2HI(g)△H=-9.48KJ•mol-1
②I2(s)+H2(g)?2HI(g)△H=+26.48KJ•mol-1
下列说法正确的是( )
①I2(g)+H2(g)?2HI(g)△H=-9.48KJ•mol-1
②I2(s)+H2(g)?2HI(g)△H=+26.48KJ•mol-1
下列说法正确的是( )
| A. | ①的产物比②的产物稳定 | |
| B. | I2(s)=I2(g)△H=+17.00KJ•mol-1 | |
| C. | ②的反应物总能量比①的反应物总能量低 | |
| D. | 1molI2(g)中通入1molH2(g),发生反应时放热9.48KJ |
18.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2和10g O2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9g H2O和1mol Br2 | D. | 224ml H2(标准状况)和0.1mol N2 |
8.标准状况下有如下气体:①6.72LCH4②3.01×1023个HCl分子 ③13.6gH2S ④0.2molNH3下列对这四种气体的关系排列的组合中正确的是( )
| A. | 体积:②>③ | B. | 密度:④>① | C. | 质量:③>① | D. | 氢原子个数:①>② |
15.下列反应属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | CuO投入稀硫酸中 | ||
| C. | 高温煅烧石灰石制CO2 | D. | NaOH溶液和K2SO4溶液混合 |
13.设NA 表示阿伏加德罗常数值.下列说法正确的是( )
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| B. | 常温下,Na2O2与H2O反应生成1mol O2时,转移电子数是2NA | |
| C. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的铜离子数为NA |

 ②反应F→G仅发生中和反应
②反应F→G仅发生中和反应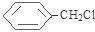 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$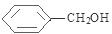 +NaCl.
+NaCl. .
. .
. 中任一种(写出一种即可).
中任一种(写出一种即可).