题目内容
15.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入等量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2 CO3 溶液中NH4+浓度的大小关系是②>④>①>③ |
分析 A.铵根离子部分水解,导致铵根离子浓度减小;
B.根据碳酸钠溶液中的质子守恒判断;
C.醋酸的电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
D.②④中铵根离子浓度大于①③,然后结合盐的水解的影响因素判断.
解答 解:A.0.1 mol/L NH4Cl溶液中,铵根离子部分水解,则c(NH4+ )<c(Cl-),故A错误;
B.0.1 mol/L Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C.向醋酸钠溶液中加入等量醋酸,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中,②④中铵根离子浓度大于①③,④中碳酸根离子促进了铵根离子的水解,则铵根离子浓度②>④;③中氢离子抑制了铵根离子的水解,则铵根离子浓度①<③,所以NH4+浓度的大小关系是②>④>③>①,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
3.下列关于S、Si、N、Cl等非金属元素化合物的说法正确的是( )
| A. | SiO2是制造太阳能电池板的主要材料 | |
| B. | NO、NO2是大气污染物,能在空气中稳定存在 | |
| C. | 漂白精的有效成分是Ca(ClO)2 | |
| D. | Fe与S化合生成Fe2S3 |
10.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
20.下列过程或现象与盐类水解无关的是( )
| A. | 可用碳酸钠与醋酸溶液制取少量二氧化碳 | |
| B. | 将NaHCO2与Al2(SO4)3两种溶液配制泡沫灭火剂 | |
| C. | 热的纯碱溶液的去污能力更强 | |
| D. | 实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
7.下列各组离子在指定溶液中可能大最共存的是( )
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
5.下列物质中属于盐的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | KNO3 |
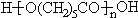 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: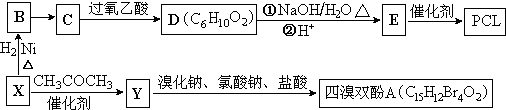


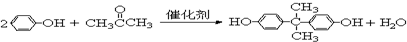 .
.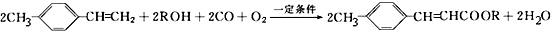
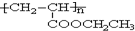 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: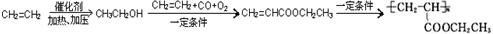 .
. ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.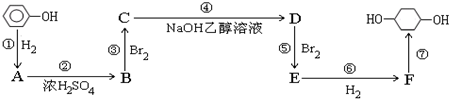
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;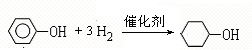 ;
;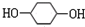 +2NaBr.
+2NaBr.