题目内容
6.下列物质易溶于水的是①④⑦⑧,易溶于CCl4的是②③⑤⑥ (均填序号).①NH3 ②CH4 ③
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
分析 根据相似相溶原理,非极性分子易溶于非极性溶剂,CCl4是非极性溶剂,据此分析.
解答 解:①NH3、④HCl、⑦HNO3、⑧SO2,都是极性分子,根据相似相溶原理,易溶于极性溶剂水;
②CH4 ③ ④HCl ⑤C2H4 ⑥Br2 为非极性分子,根据相似相溶原理,易溶于非极性溶剂四氯化碳;
④HCl ⑤C2H4 ⑥Br2 为非极性分子,根据相似相溶原理,易溶于非极性溶剂四氯化碳;
故答案为:①④⑦⑧;②③⑤⑥.
点评 本题考查了物质的溶解性,明确相似相溶原理,准确判断物质分子的极性是解题关键,题目难度中等.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | “酸雨”、“温室效应”的形成都与化石燃料的燃烧有关 | |
| B. | NaHCO3是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 氢氧化铁胶体具有吸附性,因而常用于净水 | |
| D. | 硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
14.下列各组物质在溶液中进行反应,可以用同一离子方程式表示的是( )
| A. | Na2CO3和HNO3;NaHCO3和HNO3 | B. | BaCl2和Na2CO3;Ba(OH)2和K2CO3 | ||
| C. | Ba(OH)2和NaHSO4;Ba(OH)2和H2SO4 | D. | NaOH和HF;Ba(OH)2和HNO3 |
1.根据键能数据(H-Cl 431kJ/mol,H-I 297kJ/mol),可得出的结论是( )
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
15.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入等量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2 CO3 溶液中NH4+浓度的大小关系是②>④>①>③ |
16.甲苯、四氯化碳、己烯、碘化钾溶液、亚硫酸钠溶液均为无色液体,只用一种试剂就可鉴别的是( )
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |

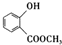 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
 ;
; HClO+OH-;
HClO+OH-;