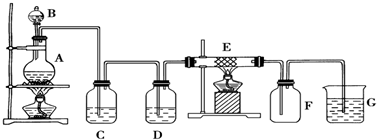
题目内容
15.下列实验中,对应的现象及结论都正确且存在因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.干燥管中的白色粉末先变成天蓝色,说明生成五水硫酸铜晶体,后又变成深蓝色,生成铜氨络离子;
B.二氧化硫具有较强还原性,容易被高锰酸钾溶液氧化;
C.原溶液中可能含有亚硫酸根离子;
D.稀硫酸与氢氧化铜反应,加入氢氧化铜之前应该先用氢氧化钠溶液中和稀硫酸.
解答 解:A.干燥管中的白色粉末先变成天蓝色,说明生成五水硫酸铜晶体,后又变成深蓝色,生成铜氨络离子,可证明加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气,故A正确;
B.向KMnO4溶液中通入SO2气体,溶液紫红色褪去,二者发生了氧化还原反应,二氧化硫表现了还原性,故B错误;
C.向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,该沉淀为硫酸钡,由于稀硝酸具有强氧化性,则原溶液中可能含有SO32-,故C错误;
D.取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,先用氢氧化钠溶液中和至碱性,然后取少量溶液加入少量新制Cu(OH)2,加热4min,加入氢氧化铜浊液之前应该先用氢氧化钠溶液中和稀硫酸,否则影响测定结果,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、二氧化硫性质、蔗糖水解等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
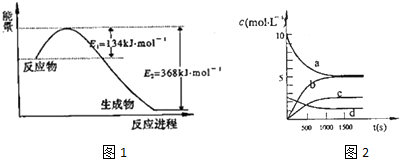
(1)图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})•c({O}_{2})}$,已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol•L-1•s-1.

(1)图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol•L-1•s-1.
3.表是元素周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
(1)④⑤⑥的原子半径由大到小的顺序为Na>Al>O
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3
(3)⑦⑧⑨的第一电离能由小到大的顺序为Si<S<P
(4)比较④和⑨的氢化物的稳定性大小H2O>H2S,沸点高低H2O>H2S
(5)写出元素⑩的+1价含氧酸的结构式H-O-Cl.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3
(3)⑦⑧⑨的第一电离能由小到大的顺序为Si<S<P
(4)比较④和⑨的氢化物的稳定性大小H2O>H2S,沸点高低H2O>H2S
(5)写出元素⑩的+1价含氧酸的结构式H-O-Cl.
10.下列物质中,不能发生水解反应的是( )
| A. | 纤维素 | B. | 淀粉 | C. | 葡萄糖 | D. | 蛋白质 |
20.在恒容的密闭容器内放入5molSO2和5molO2,在某温度下经过反应生成2molSO3,此时密闭容器内压强是反应前压强的( )
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
7.向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)?xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L•min),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )
| A. | x:y=3:1 | B. | v(A):v(C)=2:1 | ||
| C. | A的平衡浓度为0.4mol/L | D. | A与B的平衡浓度之比为3:2 |
4.已知质量分数为25%的氨水的密度为0.91g/cm3,用等体积的水稀释后,所得氨水溶液的质量分数是( )
| A. | 小于12.5% | B. | 等于12.5% | C. | 大于12.5% | D. | 无法估计 |
5.已知反应C(石墨)?C(金刚石)△H>0,下列判断正确的是( )
| A. | 石墨比金刚石稳定 | B. | 12 g金刚石的能量比12 g石墨的低 | ||
| C. | 金刚石比石墨稳定 | D. | 金刚石和石墨不能相互转化 |