题目内容
6.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.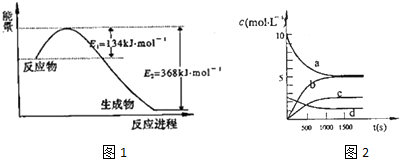
(1)图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol•L-1•s-1.
分析 (1)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,结合热化学方程式的书写规则书写;利用写出的热化学方程式,结合给出的热化学方程式,利用盖斯定律,获得所需热化学方程式的焓变;
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热;
②NO2转化率为已转化的NO2物质的量与起始物质的量的百分比;增大NO2的转化率,促进反应的正向移动即可;
③N2O5为生成物且反应为可逆反应,反应不可能进行到底,以此判断表示N2O5的浓度的变化曲线;求出NO2的反应速率,利用反应速率之比等于计量数之比,求得O2的平均速率.
解答 解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:①NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;②N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,反应①×2-②,可得到:2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=-760.3kJ•mol-1;
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;-760.3kJ•mol-1;
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})•c({O}_{2})}$;温度低,化学平衡常数大,则正反应放热,
故答案为:$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})•c({O}_{2})}$;放热;
②转化的NO2的物质的量为20mol-10.08mol=9.92mol,转化率为$\frac{9.92mol}{20mol}×100%$=49.6%;
A、该反应为放热反应,降低温度,化学平衡向右移动,故A正确;
B、反应气体浓度不变,化学平衡不移动,故B错误;
C、再充入NO2,转化的物质的量增大,但是起始的物质的量增大较多,转化率降低,故C错误;
D、加入气体比例与原平衡NO2的转化率相同,由于加入气体后,体系压强增大,NO2的转化率增大,故D正确;
故答案为:49.6%;AD;
③N2O5为生成物浓度增大,反应为可逆反应,不可能进行到底,即N2O5的浓度不可能达到5mol/L;NO2从0~500s的化学反应速率为:$\frac{(20-13.96)mol}{2L•500s}$=6.04×10-3mol•L-1•s-1,则O2速率为$\frac{6.04×10-3mol•{L}^{-1}•{s}^{-1}}{4}$=1.51×10-3mol•L-1•s-1,
故答案为:c;1.51×10-3mol•L-1•s-1.
点评 本题综合考查化学平衡影响因素、化学平衡的计算,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,题目计算量较大,难度较大,关键是构建平衡建立的等效途径,注意从正、逆不同方向建立的等效平衡转化率、反应热的关系.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 1.8×10-7 mol•L-1,2 | B. | 1×10-7 mol•L-1,2 | ||
| C. | 1.8×10-7 mol•L-1,3 | D. | 1×10-7 mol•L-1,3 |
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过如图碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据如表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为放热(吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时,n(CO2)=0.40 mol.
(2)写出方法B制备氢气的离子方程式;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率.
(4)反应:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1.
(5)某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |

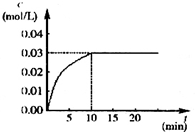 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: