题目内容
3.表是元素周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3
(3)⑦⑧⑨的第一电离能由小到大的顺序为Si<S<P
(4)比较④和⑨的氢化物的稳定性大小H2O>H2S,沸点高低H2O>H2S
(5)写出元素⑩的+1价含氧酸的结构式H-O-Cl.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为S、⑩为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,但ⅡA、ⅤA元素第一电离能高于同周期相邻元素的;
(4)非金属性越强,对应氢化物的稳定性越强;分子之间形成氢键的物质的沸点较高;
(5)HClO中O原子形成2个共价键,而H原子、Cl原子均形成1个共价键.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为S、⑩为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,
故答案为:Na>Al>O;
(2)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,但P元素3p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:Si<S<P,
故答案为:Si<S<P;
(4)非金属性O>S,氢化物的稳定性与元素非金属性一致,故氢化物稳定性:H2O>H2S,水分子之间存在氢键,而硫化氢分子之间为范德华力,氢键比较范德华力更强,故沸点:H2O>H2S,
故答案为:H2O>H2S;H2O>H2S;
(5)根据稳定结构,可知HClO中O原子形成2个共价键,而H原子、Cl原子均形成1个共价键,其结构式为H-O-Cl,
故答案为:H-O-Cl.
点评 本题考查元素周期表与元素周期律,熟练掌握短周期元素在周期表中的位置,注意同周期主族元素中第一电离能递变规律中异常情况,(5)中结构式书写为易错点,容易受化学式影响.

A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过如图碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据如表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为放热(吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时,n(CO2)=0.40 mol.
(2)写出方法B制备氢气的离子方程式;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率.
(4)反应:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1.
(5)某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
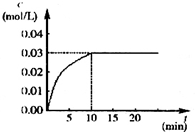 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: