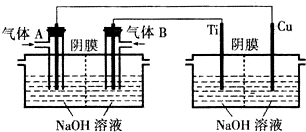
题目内容
5.某同学用下面的装置制备并收集纯净的氯化铁,硬质玻璃管E中装有细铁丝网.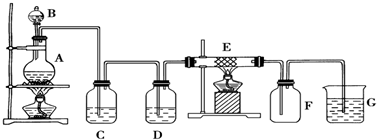
试回答:
(1)检验装置A的气密性的方法是用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好.
(2)装置A中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)装置C的作用是:吸收HCl,装置D中的试剂是:浓硫酸.
(4)可检验装置E中生成的物质中阳离子的方法及现象是硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀).
(5)若把氯气通入石蕊溶液中,观察的现象是:先变红后褪色.
(6)装置 G中发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.
分析 实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在如图的装置中,A是Cl2发生装置,B中是浓盐酸,A中是MnO2,C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,E是硬质玻璃管中装有细铁丝网,氯气通过会发生反应生成氯化铁,F为干燥的广口瓶是用来收集氯气的集气瓶,烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气,以此解答该题.
(1)检查装置气密性可以使用让装置温度升高压强增大的方法,观察气泡或液面变化;
(2)A是Cl2发生装置,二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水;
(3)C、D为气体的净化装置,C除去氯气中的氯化氢,D吸收氯气中的水蒸气;
(4)装置E中生成的物质中阳离子为铁离子,根据检验铁离子的方法分析;
(5)氯水具有酸性和漂白性;
(6)氢氧化钠溶液吸收氯气,二者反应生成氯化钠、次氯酸钠和水.
解答 解:(1)检验装置A的气密性的方法为:用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好,
故答案为:用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好;
(2)装置A中二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,
故答案为:吸收HCl;浓硫酸;
(4)装置E中生成的物质中阳离子为铁离子,检验铁离子的方法为:硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀),
故答案为:硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀);
(5)氯气与水反应生成氯化氢和次氯酸,所以氯水具有酸性和漂白性,若把氯气通入石蕊溶液中,溶液会先变红后褪色,
故答案为:先变红后褪色;
(6)烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握氯气的制备方法及化学性质,试题培养了学生的分析、理解能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| B. | Al在浓硫酸中会“钝化”能用铝槽盛放浓硫酸 | |
| C. | 四氯化碳常用作灭火剂 | |
| D. | 在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
| A. | 1.8×10-7 mol•L-1,2 | B. | 1×10-7 mol•L-1,2 | ||
| C. | 1.8×10-7 mol•L-1,3 | D. | 1×10-7 mol•L-1,3 |
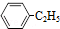 (g)?
(g)?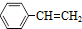 (g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:
(g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20min的平均速率为v(H2)=0.008mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol•L-1,则a<0 | |
| C. | 保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,再次达到平衡时乙苯的转化率小于50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 molH2,达到平衡前v(正)>v(逆) |
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过如图碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据如表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为放热(吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时,n(CO2)=0.40 mol.
(2)写出方法B制备氢气的离子方程式;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率.
(4)反应:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1.
(5)某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.