题目内容
7.向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)?xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L•min),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )| A. | x:y=3:1 | B. | v(A):v(C)=2:1 | ||
| C. | A的平衡浓度为0.4mol/L | D. | A与B的平衡浓度之比为3:2 |
分析 A、根据△c=v•△t计算△c(C),结合D的平衡浓度,利用浓度变化量之比等于化学计量数之比确定x:y的值;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,得x;
C、根据D的平衡浓度计算△c(A),c(A)起始-△c(A)=c(A)平衡;
D、根据D的平衡浓度计算△c(A)、△c(B),起始浓度-浓度变化量=平衡浓度,据此计算判断.
解答 解:A、△c(C)=0.3mol/(L•min)×2min=0.6mol/L,D的平衡浓度为0.3mol/L,浓度变化量之比等于化学计量数之比,故x:y=0.6mol/L:0.3mol/L=2:1,故A错误;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,所以v(A):v(C)=2:2=1:1,故B错误;
C、由A、B分析可知y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为$\frac{5mol}{5L}$-0.6mol/L=0.4mol/L.故C正确;
D、y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为$\frac{5mol}{5L}$-0.6mol/L=0.4mol/L,△c(B)=3×0.3mol/L=0.9mol/L,B的平衡浓度为$\frac{8mol}{5L}$-0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;
故选C.
点评 本题考查化学平衡及反应速率的有关计算,难度不大,推断x、y的值是关键,注意基础知识理解掌握.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.下列实验中,对应的现象及结论都正确且存在因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |
12.下列对HCl、Cl2、H2O、NH3、CH4这组分子中共价键形成方式的分析正确的是( )
| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
16.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-30℃\;}}{\;}$2K2FeO4+6KCl+8H2O.下列有关该反应说法正确的是( )
| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |
2.用途广泛,是最重要的化工产品之一,请回答下列问题:
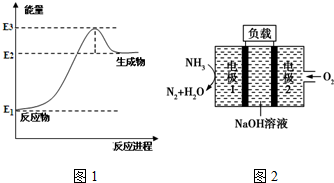
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).
(2)已知合成氨反应的平衡常数K值和温度的关系如下:
①由上表数据可知该反应为放热反应,理由是温度升高,平衡常数减小;
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
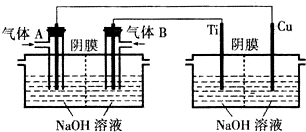
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).

(2)已知合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.