题目内容
5.已知反应C(石墨)?C(金刚石)△H>0,下列判断正确的是( )| A. | 石墨比金刚石稳定 | B. | 12 g金刚石的能量比12 g石墨的低 | ||
| C. | 金刚石比石墨稳定 | D. | 金刚石和石墨不能相互转化 |
分析 反应C(石墨)?C(金刚石)的△H>0,说明石墨具有的能量小于金刚石,则石墨比金刚石稳定,二者的质量相等时,石墨具有的能量比金刚石小,据此进行解答.
解答 解:反应C(石墨)?C(金刚石)的△H>0,说明石墨具有的能量小于金刚石,
A.物质能量越高,其稳定性越弱,则石墨比金刚石稳定,故A正确;
B.12 g金刚石和12 g石墨的物质的量相等,由于石墨具有的能量小于金刚石,则12 g金刚石的能量比12 g石墨的高,故B错误;
C.金刚石比如石墨稳定,故C错误;
D.在一定条件下,金刚石和石墨可以相互转化,故D错误;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确物质稳定性与具有能量的关系为解答关键,注意掌握反应热与焓变的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.下列实验中,对应的现象及结论都正确且存在因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
16.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-30℃\;}}{\;}$2K2FeO4+6KCl+8H2O.下列有关该反应说法正确的是( )
| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |
13.下列各组中的两种物质在溶液中的反应/可用同一离子方程式表示的是( )
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L SO2和SO3的混合物中硫原子数为0.5NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA | |
| D. | 常温常压下,7.8 g Na2O2含有的阴离子数目为0.1NA |
10.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
2.用途广泛,是最重要的化工产品之一,请回答下列问题:
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).
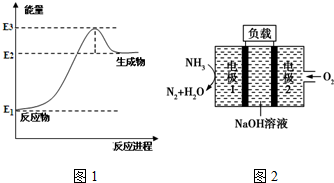
(2)已知合成氨反应的平衡常数K值和温度的关系如下:
①由上表数据可知该反应为放热反应,理由是温度升高,平衡常数减小;
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).

(2)已知合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
19.2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1000.3 kJ/mol | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(l);△H=-1135.7 kJ/mol | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
20.下列实验操作不正确的是( )
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验 | |
| B. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| C. | 向试管中先加入无水乙醇,再加入适量冰醋酸与一定量浓硫配制的混酸,然后加热制取乙酸乙酯 | |
| D. | 验证蔗糖水解产物时,将反应后的溶液与银氨溶液混合水浴加热,观察现象 |