题目内容
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,金属的电化学腐蚀与防护,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,电化学专题
分析:A、在金属活动性顺序表中,铜在氢之后,铜不能将氢气置换出;
B、根据c(OH-)=
分析;
C、亚硫酸氢钠溶液显酸性是因为亚硫酸氢根离子的电离程度大于其水解程度;
D、温度升高Ca(OH)2的溶解度变小.
B、根据c(OH-)=
| KW |
| c(H+) |
C、亚硫酸氢钠溶液显酸性是因为亚硫酸氢根离子的电离程度大于其水解程度;
D、温度升高Ca(OH)2的溶解度变小.
解答:
解:A、在金属活动性顺序表中,铜在氢之后,铜不能将氢气置换出,故铜不能发生析氢腐蚀,故A错误;
B、常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由c(OH-)=
可知氢氧根离子的浓度增大,故B错误;
C、亚硫酸氢钠溶液显酸性是因为亚硫酸氢根离子的电离程度大于其水解程度,亚硫酸为弱酸,亚硫酸氢钠的电离方程式为:NaHSO3=Na++HSO3-,故C错误;
D、温度升高Ca(OH)2的溶解度变小,故升高温度,Ca(OH)2的溶解速率增大,但其Ksp减小,故D正确.
故选D.
B、常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由c(OH-)=
| KW |
| c(H+) |
C、亚硫酸氢钠溶液显酸性是因为亚硫酸氢根离子的电离程度大于其水解程度,亚硫酸为弱酸,亚硫酸氢钠的电离方程式为:NaHSO3=Na++HSO3-,故C错误;
D、温度升高Ca(OH)2的溶解度变小,故升高温度,Ca(OH)2的溶解速率增大,但其Ksp减小,故D正确.
故选D.
点评:本题考查了金属的腐蚀和溶液稀释时离子浓度的变化,应注意的是,铜在氢之后,铜不能将氢气置换出,故铜不能发生析氢腐蚀.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列溶液中有关物质的量浓度关系不正确的( )
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
下列有关SO2与SiO2的比较,正确的是( )
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |

 (1)25℃时,0.1mol?L-1的HA溶液中
(1)25℃时,0.1mol?L-1的HA溶液中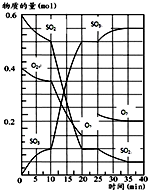 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.