题目内容
按要求回答下列问题:
(1)钠镁铝三种元素中第一电离能最大的是 .
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 .
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为 ,
草酸钠晶体中存在 .
A.金属键 B.非极性键 C.π键 D.范德华力 E.氢键 F.离子键
(4)部分共价键键能数据如下表:
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式 .
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是 .
(6)PCl5晶体中只有PCl+、Cl6-两种微粒,其晶体结构与氯化铯相同.PCl5晶体类型是 ;PCl4+的空间构型为
(7)PtCl4和氨水反应可获得PtCl4?4NH3,PtCl4?4NH3是一种配合物.100mL0.1mol?L-1PtCl4?4NH3溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀.该配合物的化学式为 .
(1)钠镁铝三种元素中第一电离能最大的是
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为
草酸钠晶体中存在
A.金属键 B.非极性键 C.π键 D.范德华力 E.氢键 F.离子键
(4)部分共价键键能数据如下表:
| 共价键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)PCl5晶体中只有PCl+、Cl6-两种微粒,其晶体结构与氯化铯相同.PCl5晶体类型是
(7)PtCl4和氨水反应可获得PtCl4?4NH3,PtCl4?4NH3是一种配合物.100mL0.1mol?L-1PtCl4?4NH3溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀.该配合物的化学式为
考点:元素电离能、电负性的含义及应用,判断简单分子或离子的构型,配合物的成键情况,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)同周期元素从左到右,第一电离能呈增大趋势;
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;
(3)依据名称书写结构简式;同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键;
(4)化学反应的实质是旧键的断裂和新键的形成,反应热等于反应物总键能减生成物总键能;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能;
(6)PCl5晶体由PCl4+和PCl6-构成,属于离子晶体;根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断空间构型;
(7)滴加足量AgNO3溶液可产生2.87g白色沉淀为AgCl沉淀,据此分析.
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;
(3)依据名称书写结构简式;同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键;
(4)化学反应的实质是旧键的断裂和新键的形成,反应热等于反应物总键能减生成物总键能;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能;
(6)PCl5晶体由PCl4+和PCl6-构成,属于离子晶体;根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断空间构型;
(7)滴加足量AgNO3溶液可产生2.87g白色沉淀为AgCl沉淀,据此分析.
解答:
解:(1)同周期元素从左到右,第一电离能呈增大趋势,元素的金属性Na>Mg>Al,但是由于镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高,故答案为:Mg;
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;即质子数为27,此元素为锰,元素符号为Mn,故答案为:Mn;
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为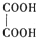 ,草酸钠晶体中含有钠离子和乙二酸根离子之间的离子键,含有碳氧单键中氧和碳之间的极性共价键,含有碳碳单键中的非极性共价键,碳氧双键中存在含有一个σ键一个π键,
,草酸钠晶体中含有钠离子和乙二酸根离子之间的离子键,含有碳氧单键中氧和碳之间的极性共价键,含有碳碳单键中的非极性共价键,碳氧双键中存在含有一个σ键一个π键,
故答案为: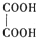 ;BCF;
;BCF;
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是△H=3×436 kJ/mol+945 kJ/mol-2×3×391kJ/mol=-89kJ/mol,
即热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-89kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-89kJ/mol;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能,故答案为:乙醇分子间能形成氢键,而二甲醚不能;
(6)由题中信息可知,PCl5在固态时由PCl4+和PCl6-两种离子构成,属于离子晶体,PCl4+的含有4个σ键且不含孤电子对,所以其采用sp3杂化,空间构型是正四面体,故答案为:离子晶体;正四面体;
(7)n(AgCl)=
=0.02mol,100mL0.1mol?L-1 PtCl4?4NH3中n(PtCl4?4NH3)=0.01mol,则1mol配合物可电离出2mol氯离子,所以此配合物的化学式为:〔PtCl2(NH3)4〕Cl2,故答案为:〔PtCl2(NH3)4〕Cl2.
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;即质子数为27,此元素为锰,元素符号为Mn,故答案为:Mn;
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为
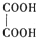 ,草酸钠晶体中含有钠离子和乙二酸根离子之间的离子键,含有碳氧单键中氧和碳之间的极性共价键,含有碳碳单键中的非极性共价键,碳氧双键中存在含有一个σ键一个π键,
,草酸钠晶体中含有钠离子和乙二酸根离子之间的离子键,含有碳氧单键中氧和碳之间的极性共价键,含有碳碳单键中的非极性共价键,碳氧双键中存在含有一个σ键一个π键,故答案为:
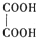 ;BCF;
;BCF;(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是△H=3×436 kJ/mol+945 kJ/mol-2×3×391kJ/mol=-89kJ/mol,
即热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-89kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-89kJ/mol;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能,故答案为:乙醇分子间能形成氢键,而二甲醚不能;
(6)由题中信息可知,PCl5在固态时由PCl4+和PCl6-两种离子构成,属于离子晶体,PCl4+的含有4个σ键且不含孤电子对,所以其采用sp3杂化,空间构型是正四面体,故答案为:离子晶体;正四面体;
(7)n(AgCl)=
| 2.87g |
| 143.5g/mol |
点评:本题考查了物质结构及其性质,涉及元素周期律、热化学反应方程式书写、晶体类型的判断等知识点,根据价层电子对互斥理论、构造原理等知识来分析解答,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
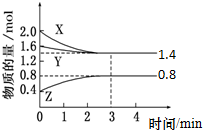 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
下列表述不正确的是( )
| A | B | C | D |
 |  |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A、A | B、B | C、C | D、D |
下列反应不属于氧化还原反应的是( )
| A、木炭与浓硫酸反应 |
| B、盐酸与氧化钙反应 |
| C、铜与稀硝酸反应 |
| D、铁粉与水蒸气反应 |
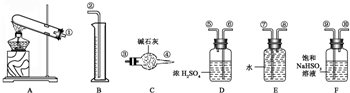
 氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:
氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答: