题目内容
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.
(1)请写出H2O2的电子式 .
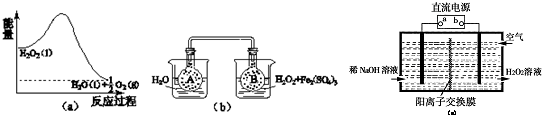
(2)H2O2分解过程的能量变化如图(a)所示,试判断该反应为 反应(吸热或放热).
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:□Fe2++□H2O2+□ ═□ +□
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)?N2O4(g),△H<0)进行实验.可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是
(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物.
试回答:
①流电源a极的名称是 .
②写出阴极电极反应式 .
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol?L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 .

(1)请写出H2O2的电子式
(2)H2O2分解过程的能量变化如图(a)所示,试判断该反应为
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:□Fe2++□H2O2+□
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)?N2O4(g),△H<0)进行实验.可观察到B瓶中气体颜色比A瓶中的
(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物.
试回答:
①流电源a极的名称是
②写出阴极电极反应式
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
考点:过氧化氢,吸热反应和放热反应,化学平衡的影响因素,电解原理
专题:
分析:(1)过氧化氢是共价化合物,氢原子和氧原子形成共用电子对;
(2)H2O2分解过程的能量变化如图(a)所示,过氧化氢能量高于生成物,反应放热;
①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应的方程式;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动;
(3)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极;电解法需消耗电能,而催化法常温下即可进行;
(4)溶液变成蓝色,铜被氧化成铜离子:Cu+H2O2+H2SO4
CuSO4+2H2O;当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
(2)H2O2分解过程的能量变化如图(a)所示,过氧化氢能量高于生成物,反应放热;
①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应的方程式;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动;
(3)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极;电解法需消耗电能,而催化法常温下即可进行;
(4)溶液变成蓝色,铜被氧化成铜离子:Cu+H2O2+H2SO4
| ||
解答:
解:(1)过氧化氢是共价化合物,氢原子和氧原子形成共用电子对,电子式为 ,故答案为:
,故答案为: ,
,
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,故答案为:放热;
①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2,1,2H+,2 Fe3+,2H2O.
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深; 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动;
(3)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,
故答案为:正极;O2+2e-+2H2O=H2O2+2OH-;
(4)铜与H2O2 和H2SO4 反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4
CuSO4+2H2O,铜溶解的离子方程式H2O2+2H++Cu=Cu2++2H2O;由于温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:H2O2+2H++Cu=Cu2++2H2O;温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
 ,故答案为:
,故答案为: ,
,(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,故答案为:放热;
①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2,1,2H+,2 Fe3+,2H2O.
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深; 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动;
(3)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,
故答案为:正极;O2+2e-+2H2O=H2O2+2OH-;
(4)铜与H2O2 和H2SO4 反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4
| ||
故答案为:H2O2+2H++Cu=Cu2++2H2O;温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
点评:本题考查电解原理、反应速率影响因素、化学平衡移动等,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
实验中需用2.0mol?L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
| A、100 mL;21.2 g |
| B、500 mL;100.7 g |
| C、1000 mL;201.4 g |
| D、1 000 mL;212.0 g |
常温下,将乙酸和氢氧化钠溶液混合,所得溶液 pH>7,则此溶液中( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
下列有关实验的叙述中正确的是( )
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |