题目内容
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛的.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号).
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
NaClO3溶液
KClO3晶体
①完成Ⅰ中反应的总化学方程式:NaCl+H2O=NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 .
(4)MgCl2在工业上应用广泛,可由MgO制备.
①MgCl2电子式为 .
②MgO与碳粉和过量氯气在一定条件下反应可制备MgCl2.若尾气可用足量NaOH溶液完全吸收,则生成的盐为 (写化学式).
③MgCl2晶体是制备金属镁的原料,实验室将MgCl2溶液蒸干灼烧得不到MgCl2晶体,试从平衡移动角度解释其原因 .
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
①完成Ⅰ中反应的总化学方程式:NaCl+H2O=NaClO3+
②Ⅱ中转化的基本反应类型是
(4)MgCl2在工业上应用广泛,可由MgO制备.
①MgCl2电子式为
②MgO与碳粉和过量氯气在一定条件下反应可制备MgCl2.若尾气可用足量NaOH溶液完全吸收,则生成的盐为
③MgCl2晶体是制备金属镁的原料,实验室将MgCl2溶液蒸干灼烧得不到MgCl2晶体,试从平衡移动角度解释其原因
考点:氯、溴、碘及其化合物的综合应用,镁、铝的重要化合物
专题:
分析:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,据此书写F的原子结构示意图;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
NaClO3溶液
KClO3晶体
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;
两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(4)①氯化镁是离子化合物,结合形成过程书写电子式;
②MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物;
③MgCl2晶体是制备金属镁的原料,实验室将MgCl2溶液蒸干灼烧得不到MgCl2晶体,是因为氯化镁水解生成氢氧化镁和氯化氢,氯化氢挥发得到水解产物.
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;
两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(4)①氯化镁是离子化合物,结合形成过程书写电子式;
②MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物;
③MgCl2晶体是制备金属镁的原料,实验室将MgCl2溶液蒸干灼烧得不到MgCl2晶体,是因为氯化镁水解生成氢氧化镁和氯化氢,氯化氢挥发得到水解产物.
解答:
解:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,则F的原子结构示意图为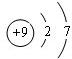 ,故答案为:
,故答案为: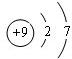 ;
;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
NaClO3溶液
KClO3晶体
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为1NaCl+3H2O═1NaClO3+3H2↑,
故答案为:1;3;1;3;3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①氯化镁是离子化合物,结合形成过程书写电子式为: ,故答案为:
,故答案为: ;
;
②MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:NaCl,NaClO,Na2CO3 ;
③MgCl2溶液中存在水解平衡:MgCl2+2H2O?Mg(OH)2+2HCl,加热促进水解平衡右移,HCl易挥发,使得水解完全,生成Mg(OH)2,继续灼烧最终变成MgO;
故答案为:MgCl2溶液中存在水解平衡:MgCl2+2H2O?Mg(OH)2+2HCl,加热促进水解平衡右移,HCl易挥发,使得水解完全,生成Mg(OH)2,继续灼烧最终变成MgO.
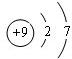 ,故答案为:
,故答案为: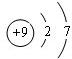 ;
;(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为1NaCl+3H2O═1NaClO3+3H2↑,
故答案为:1;3;1;3;3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①氯化镁是离子化合物,结合形成过程书写电子式为:
 ,故答案为:
,故答案为: ;
;②MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:NaCl,NaClO,Na2CO3 ;
③MgCl2溶液中存在水解平衡:MgCl2+2H2O?Mg(OH)2+2HCl,加热促进水解平衡右移,HCl易挥发,使得水解完全,生成Mg(OH)2,继续灼烧最终变成MgO;
故答案为:MgCl2溶液中存在水解平衡:MgCl2+2H2O?Mg(OH)2+2HCl,加热促进水解平衡右移,HCl易挥发,使得水解完全,生成Mg(OH)2,继续灼烧最终变成MgO.
点评:本题考查了原子结构,电子式书写,物质组成和结构的理解应用,主要是物质性质的分析判断,氧化还原反应配平和盐类水解基础知识是解答关键,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
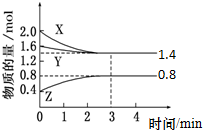 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |