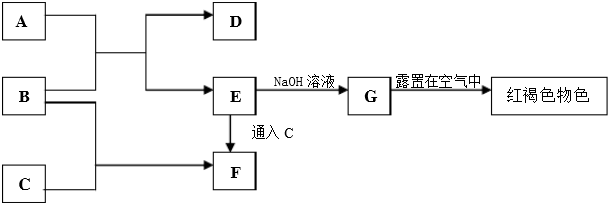
题目内容
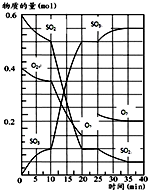 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.(1)反应在10min至15min时间段,SO3的反应速率为
(2)根据曲线变化趋势看出,反应进行至25min时,采取的措施为
(3)不考虑25min后的变化情况,下列说法正确的是
a.其他条件不变,反应在绝热容器中进行达到平衡时SO2的转化率更大
b.其他条件不变,若在容积可变的密闭容器中进行反应,SO3的产量和平衡常数均增大
c.其他条件不变,向该密闭容器充入1mol 氦气,压强增大,平衡正向移动
d.其他条件不变,若将起始反应物的量加倍,达新平衡时O2的浓度小于0.15mol/L
(4)若保持其他条件不变,起始时充入a mol SO2、b mol O2、c mol SO3,欲使平衡混合物中各组成与
20~25min段相同,则a、b应满足的关系为
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据v=
计算;
(2)根据曲线变化趋势看出,反应进行至25min时,氧气的物质的量瞬间增大,而另外两种物质没有变化,所以此时改变的条件为增加氧气的量,平衡正向移动,SO2的体积分数减小,据此答题;
(3)a.其他条件不变,反应在绝热容器中进行,反应体系的温度升高,平衡逆向移动,所以达到平衡时SO2的转化率减小;
b.其他条件不变,若在容积可变的密闭容器中进行反应,平衡常数只与温度有关,所以不变化;
c.其他条件不变,向该密闭容器充入1mol 氦气,由于体积没有变化,各物质浓度也不变,所以平衡不移动;
d.其他条件不变,若将起始反应物的量加倍,体系压强增大,平衡正向移动,达新平衡时O2的浓度小于0.15mol/L;
(4)由图可知二氧化硫、氧气的起始物质的量分别为0.6mol、0.4mol,欲使新平衡混合物中各组成与20~25min段相同,即为恒温恒容下的等效平衡,应满足二者起始浓度之比为2:1,且将三氧化硫完全转化为二氧化硫和氧气时,总的二氧化硫的物质的量、氧气的物质的量与起始的二氧化硫、氧气起始物质的量对应相等;要使反应逆向进行,生成物的物质的量比平衡时的物质的量要多一些,据此判断.
| ||
| △t |
(2)根据曲线变化趋势看出,反应进行至25min时,氧气的物质的量瞬间增大,而另外两种物质没有变化,所以此时改变的条件为增加氧气的量,平衡正向移动,SO2的体积分数减小,据此答题;
(3)a.其他条件不变,反应在绝热容器中进行,反应体系的温度升高,平衡逆向移动,所以达到平衡时SO2的转化率减小;
b.其他条件不变,若在容积可变的密闭容器中进行反应,平衡常数只与温度有关,所以不变化;
c.其他条件不变,向该密闭容器充入1mol 氦气,由于体积没有变化,各物质浓度也不变,所以平衡不移动;
d.其他条件不变,若将起始反应物的量加倍,体系压强增大,平衡正向移动,达新平衡时O2的浓度小于0.15mol/L;
(4)由图可知二氧化硫、氧气的起始物质的量分别为0.6mol、0.4mol,欲使新平衡混合物中各组成与20~25min段相同,即为恒温恒容下的等效平衡,应满足二者起始浓度之比为2:1,且将三氧化硫完全转化为二氧化硫和氧气时,总的二氧化硫的物质的量、氧气的物质的量与起始的二氧化硫、氧气起始物质的量对应相等;要使反应逆向进行,生成物的物质的量比平衡时的物质的量要多一些,据此判断.
解答:
解:(1)10min至15min时间段,SO3的变化的物质的量为0.35mol-0.1mol=0.25mol,根据v=
可知SO3的反应速率为
=0.025 mol/(L?min),
故答案为:0.025 mol/(L?min);
(2)根据曲线变化趋势看出,反应进行至25min时,氧气的物质的量瞬间增大,而另外两种物质没有变化,所以此时改变的条件为增加氧气的量,平衡正向移动,SO2的体积分数减小,
故答案为:补充氧气; 变小;
(3)a.其他条件不变,反应在绝热容器中进行,反应体系的温度升高,平衡逆向移动,所以达到平衡时SO2的转化率减小,故a错误;
b.其他条件不变,若在容积可变的密闭容器中进行反应,平衡常数只与温度有关,所以不变化,故b错误;
c.其他条件不变,向该密闭容器充入1mol 氦气,由于体积没有变化,各物质浓度也不变,所以平衡不移动,故c错误;
d.其他条件不变,若将起始反应物的量加倍,体系压强增大,平衡正向移动,达新平衡时O2的浓度小于0.15mol/L,故d正确;
故选d;
(4)由图可知二氧化硫、氧气的起始物质的量分别为0.6mol、0.4mol,欲使新平衡混合物中各组成与20~25min段相同,即为恒温恒容下的等效平衡,应满足二者起始浓度之比为2:1,且将三氧化硫完全转化为二氧化硫和氧气时,总的二氧化硫的物质的量、氧气的物质的量与起始的二氧化硫、氧气起始物质的量对应相等,即有a+c=0.6,b+
c=0.4,所以有2b-a=0.2,因为a、c均大于0,所以0.1≤b≤0.4,要使反应逆向进行,生成物的物质的量比平衡时的物质的量要多一些,在20~25min段时,三氧化硫的物质的量为0.5mol,所以有0.5<c≤0.6,
故答案为:2b-a=0.2; 0.1≤b≤0.4; 0.5<c≤0.6.
| ||
| △t |
| ||
| 5min |
故答案为:0.025 mol/(L?min);
(2)根据曲线变化趋势看出,反应进行至25min时,氧气的物质的量瞬间增大,而另外两种物质没有变化,所以此时改变的条件为增加氧气的量,平衡正向移动,SO2的体积分数减小,
故答案为:补充氧气; 变小;
(3)a.其他条件不变,反应在绝热容器中进行,反应体系的温度升高,平衡逆向移动,所以达到平衡时SO2的转化率减小,故a错误;
b.其他条件不变,若在容积可变的密闭容器中进行反应,平衡常数只与温度有关,所以不变化,故b错误;
c.其他条件不变,向该密闭容器充入1mol 氦气,由于体积没有变化,各物质浓度也不变,所以平衡不移动,故c错误;
d.其他条件不变,若将起始反应物的量加倍,体系压强增大,平衡正向移动,达新平衡时O2的浓度小于0.15mol/L,故d正确;
故选d;
(4)由图可知二氧化硫、氧气的起始物质的量分别为0.6mol、0.4mol,欲使新平衡混合物中各组成与20~25min段相同,即为恒温恒容下的等效平衡,应满足二者起始浓度之比为2:1,且将三氧化硫完全转化为二氧化硫和氧气时,总的二氧化硫的物质的量、氧气的物质的量与起始的二氧化硫、氧气起始物质的量对应相等,即有a+c=0.6,b+
| 1 |
| 2 |
故答案为:2b-a=0.2; 0.1≤b≤0.4; 0.5<c≤0.6.
点评:本题主要考查了可逆反应中反应热的计算、化学反应速率的计算、等效平衡原理的应用,有一定的综合性,难度中等.

练习册系列答案
相关题目
下列有关实验的叙述中正确的是( )
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
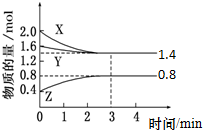 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
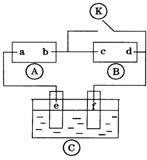 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |