题目内容
下列有关SO2与SiO2的比较,正确的是( )
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |
考点:二氧化硫的化学性质,硅和二氧化硅
专题:
分析:A.氧化物能和碱反应生成盐和水的化合物为酸性氧化物;
B.二氧化硅不溶于水;
C.SO2具有强还原性,SiO2没有;
D.酸性氧化物的通性为能够与碱反应只生成盐和水;能够与碱性氧化物反应只生成盐.
B.二氧化硅不溶于水;
C.SO2具有强还原性,SiO2没有;
D.酸性氧化物的通性为能够与碱反应只生成盐和水;能够与碱性氧化物反应只生成盐.
解答:
解:A.SO2和SiO2均能和碱反应生成盐和水,属于酸性氧化物,故A正确;
B.二氧化硅不溶于水,不与水反应,故B错误;
C.SO2具有强还原性,SiO2没有,故C错误;
D.因为酸性氧化物的通性为能够与碱反应只生成盐和水;能够与碱性氧化物反应只生成盐,所以SiO2可与HF反应不属于,故D错误.
故选A.
B.二氧化硅不溶于水,不与水反应,故B错误;
C.SO2具有强还原性,SiO2没有,故C错误;
D.因为酸性氧化物的通性为能够与碱反应只生成盐和水;能够与碱性氧化物反应只生成盐,所以SiO2可与HF反应不属于,故D错误.
故选A.
点评:本题考查了二氧化硫和二氧化硅的性质,难度不大,注意二氧化硅的特殊性.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
下列表述不正确的是( )
| A | B | C | D |
 |  |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A、A | B、B | C、C | D、D |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| B、常温下,16gO2和O3的混合气体中含有的氧原子数为NA |
| C、标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )| A、NO2是该过程的中间产物 |
| B、NO和O2必须在催化剂表面才能反应催化剂 |
| C、汽车尾气的主要污染成分是CO2和NO |
| D、该催化转化的总反应方程式为:2NO+O2+4CO═4CO2+N2 |
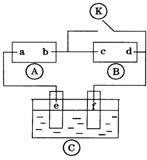 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
下列反应不属于氧化还原反应的是( )
| A、木炭与浓硫酸反应 |
| B、盐酸与氧化钙反应 |
| C、铜与稀硝酸反应 |
| D、铁粉与水蒸气反应 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、水的电离是放热过程 |
| B、放热反应的反应速率是大于吸热反应的反应速率 |
| C、生成物总能量一定低于反应物的总能量 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |