题目内容
17.如图1表示氮及其化合物在一定条件下的转化关系: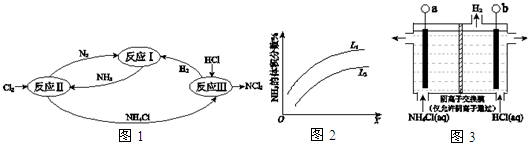
(1)反应I:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1
图2是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强.其中X代表的是压强(填“温度”或“压强”),判断L1、L2的大小关系并说明理由L1<L2 合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小.
(2)①反应II的化学方程式是8NH3+3Cl2=N2+6NH4Cl.
②反应II其中一步反应为
2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H=-462kJ•mol-1
已知:N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g) Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41 kJ.
(3)反应III是利用图3所示装置电解制备NCl3(氯的化合价为+1),其原理是:
NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑.
①b接电源的负极(填“正”或“负”).
②阳极反应式是3Cl--6e-+NH4+=NCl3+4H+.
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是NCl3+6ClO2-+3H2O=6ClO2+NH3+3Cl-+3OH-.
分析 (1)升高温度,平衡向吸热的方向移动;增大压强,平衡向气体体积缩小的方向移动;
(2))①根据流程图,反应II中氯气与氨气反应生成氮气和氯化铵;
②设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和计算;
(3)①阴极与电源负极相连,阳极与电源正极相连;
②阴极电极反应为氢离子得电子生成氢气,用总反应减掉阴极反应得阳极反应;
(4)根据氧化还原得失电子守恒配平反应.
解答 解:(1)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1为放热反应,若升高温度平衡逆向移动,前期的体积分数减小,与图象矛盾;若增大压强,平衡向正向移动,氨气的体积分数增大,故改变条件为压强;压强相同时,温度升高,平衡逆向移动,氨的体积分数减小,L1<L2,故答案为:压强;L1<L2;合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小;
(2))①根据流程图,反应II中氯气与氨气反应生成氮气和氯化铵,反应为:8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl
②设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和,-462=6x+3×243-(945+6y),x-y=41kJ,故答案为:41;
(3)①b极产生氢气,为阴极,与电源负极相连,故答案为:负;
②阴极电极反应为氢离子得电子生成氢气,用总反应减掉阴极反应得阳极反应式,故答案为:3Cl--6e-+NH4+=NCl3+4H+;
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,根据氧化还原化合价升降原理,Cl元素化合价有升高和讲点,根据得失电子守恒配平反应,故答案为:NCl3+6ClO2-+3H2O=6ClO2+NH3+3Cl-+3OH-.
点评 该题考查化学反应速率和化学平衡问题,要求正确书写方程式,学生需有扎实的基础,试题难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 离子化合物中的阳离子只能是金属离子 | |
| B. | 离子化合物中一定含有离子键 | |
| C. | 离子化合物都能溶于水,其水溶液可以导电 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | CO2和NaCl | D. | F2和NaF |
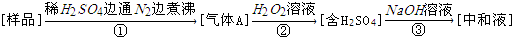
| A. | 亚硫酸盐作为食品添加剂作用是防腐、抗氧化 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
| A. | 核反应发电实现了化学能到电能的转化 | |
| B. | 115 号元素一定是处于VA 族的非金属元素 | |
| C. | 117 号元素与F、Cl、Br、I 均处于VIIA 族 | |
| D. | 四种新元素位于元素周期表中的不同周期 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl->O2->Mg2+>Al3+.
(3)⑤、⑥的单质中更容易与①的单质反应的是N2.
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)⑧、⑨、⑩三种元素形成的氢化物水溶液酸性强弱顺序为:HI>HBr>HCl.
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
| A. | 氯离子结构示意图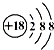 | B. | HCl的电子式 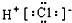 | ||
| C. | CO2的结构式 O=C=O | D. | 作为相对原子质量标准的原子614C |
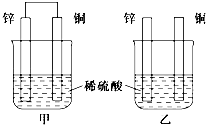 (1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:

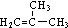 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.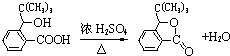 (写明反应条件).
(写明反应条件).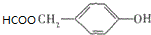 .
. )
)