题目内容
9.下列化学用语正确的是( )| A. | 氯离子结构示意图 | B. | HCl的电子式  | ||
| C. | CO2的结构式 O=C=O | D. | 作为相对原子质量标准的原子614C |
分析 A.氯离子的核电荷数为17,核外电子总数为18;
B.氯化氢为共价化合物,分子中含有1个H-Cl键;
C.由最外层电子及形成8电子稳定结构可知,存在C=O;
D.作为相对原子质量标准的原子为C-12.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: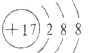 ,故A错误;
,故A错误;
B.氯化氢分子中存在1个氢氯键,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ,故B错误;
,故B错误;
C.由最外层电子及形成8电子稳定结构可知,存在C=O,则CO2分子的结构式O=C=O,故C正确;
D.作为相对原子质量标准的原子为612C,故D错误.
故选C.
点评 本题考查化学用语,涉及电子式、结构式、结构示意图以及原子表示方法等,综合性较强,注重基础知识的考查,把握化学用语的区别及规范应用,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
19.X、Y、Z、R、W是五种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A. | 离子半径:Y2->Z+ | |
| B. | 气态氢化物稳定性:HW>H2R | |
| C. | XW4分子中各原子均满足8电子稳定结构 | |
| D. | Y、Z、R三种元素组成的化合物只含有离子键 |
4.下列对分子及其性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
14.有关药品保存正确的是( )
| A. | 锂保存在煤油中 | |
| B. | 液溴保存在带橡皮塞的棕色细口玻璃瓶中 | |
| C. | 白磷保存在水里 | |
| D. | 碘单质保存在无色广口瓶中 |
1.X、Y、Z、W、M均为短周期主族元素,原子序数依次增加,X与W同族,X原子核外电子数与电子层数相等,Y与Z相邻,Z原子最外层电子数是其内层电子数的3倍,M在同周期中原子半径最小,则下列说法错误的是( )
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
18.下列变化中,吸收的热量用于克服分子间作用力的是( )
| A. | 加热铝使之熔化 | B. | 液氨受热蒸发 | ||
| C. | 加热碘化氢气体使之分解 | D. | 加热硅晶体使之熔化 |
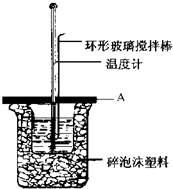 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
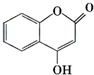 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: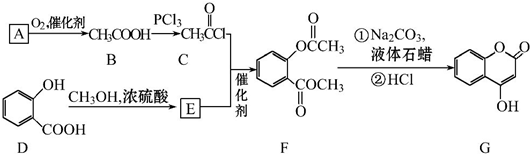
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.