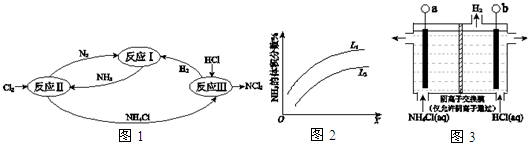
题目内容
6.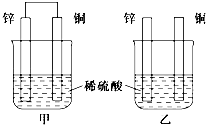 (1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:①下列说法中正确的是BD(填序号).
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中H+的浓度均减小
②在相同时间内,两烧杯中产生气泡的速率:甲>乙(填“>”、“<”或“=”).
③甲中硫酸根离子向锌极移动(填“铜”或“锌”)
④当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为0.1NA或6.02×1022.
(2)欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为Cu,电解质溶液为氯化铁溶液,正极反应为Fe3++e-═Fe2+,10min内该电池向外提供0.1mol电子,则正极材料与负极材料的质量差为3.2g(假设刚开始时,两电极的质量相等).
分析 (1)①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池工作时,阴离子向负极移动;
④根据氢气和转移电子之间的关系式计算;
(2)根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐溶液为电解质溶液,根据转移电子与Cu的关系式计算消耗Cu的质量.
解答 解:(1)①A.甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B.乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C.甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D.两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故答案为:BD;
②甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
③锌为负极,硫酸根离子向锌极移动过,故答案为:锌;
④甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=$\frac{1.12L}{22.4L/mol}$=×2=0.1mol,通过导线的电子数目为0.1NA或6.02×1022,
故答案为:0.1NA或6.02×1022;
(2)根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐溶液为电解质溶液,如FeCl3溶液;
负极反应式为Cu-2e-=Cu2+,负极上铜失电子生成铜离子进入溶液,所以铜质量在不断减少,根据转移电子与Cu的关系式得消耗Cu的质量=$\frac{0.1mol}{2}$×64g/mol=3.2g;
故答案为:Cu;氯化铁溶液;Fe3++e-═Fe2+;3.2.
点评 本题考查原电池设计,侧重考查学生设计及计算能力,会根据得失电子确定原电池正负极、电解质溶液,失电子的金属作负极、得电子的可溶性电解质溶液为该原电池电解质溶液,题目难度不大.

| A. | 锂保存在煤油中 | |
| B. | 液溴保存在带橡皮塞的棕色细口玻璃瓶中 | |
| C. | 白磷保存在水里 | |
| D. | 碘单质保存在无色广口瓶中 |
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
| A. | CuO | B. | SiO2 | C. | Al2O3 | D. | Fe2O3 |
| A. | 加热铝使之熔化 | B. | 液氨受热蒸发 | ||
| C. | 加热碘化氢气体使之分解 | D. | 加热硅晶体使之熔化 |
| A. | 体积相等的SO2和CO2 | B. | 密度不同、质量相等的CO和C2H4 | ||
| C. | 等温等体积的NO和HCl | D. | 等压等体积的N2和CH4 |