��Ŀ����
2���±���Ԫ�����ڱ���һ���֣�����Ԫ���ڱ��е�λ�ã����û�ѧ����ش��������⣺| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | O |
| 1 | �� | |||||||
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | ||||
| 4 | �� | |||||||
| 5 | �� |
��2���ۡ��ܡ��ߡ���ļ����Ӱ뾶�ɴ�С��˳��ΪCl-��O2-��Mg2+��Al3+��
��3���ݡ��ĵ����и�������ٵĵ��ʷ�Ӧ����N2��
��4���ڡ��ܵ�����������ˮ����֮�䷢����Ӧ�����ӷ���ʽAl��OH��3+OH-=AlO2-+2H2O��
��5���ࡢ�ᡢ������Ԫ���γɵ��⻯��ˮ��Һ����ǿ��˳��Ϊ��HI��HBr��HCl��
��6�������к��Т�Ԫ�أ��������к��и�Ԫ�صļ������ӣ��������ữ�£�����˫��ˮ��������Ϊ���ʣ�д���÷�Ӧ�����ӷ���ʽ2H++H2O2+2I-=2H2O+I2��
���� ��Ԫ�������ڱ��е�λ�ÿ�֪������H������Na������Mg������Al������C������N������O������Cl������Br������I��
��1��������ϼ�=������-8�������ۺ�����Ϊ�����
��2�����Ӳ�Խ�����Ӱ뾶Խ���Ӳ���ͬʱ�˵����Խ�����Ӱ뾶ԽС��
��3���ǽ�����Խǿ����������ӦԽ���ף�
��4���ڡ��ܵ�����������ˮ����ֱ�ΪNaOH��Al��OH��3�����߷�Ӧ����ƫ��������ˮ��
��5���ǽ�����Խǿ����ѧ��Խ�ȶ�������Һ��Խ��������������ӣ�
��6������������˫��ˮ��I-����Ϊ���ʣ�˫��ˮ����ԭΪˮ��
��� �⣺��Ԫ�������ڱ��е�λ�ÿ�֪������H������Na������Mg������Al������C������N������O������Cl������Br������I��
��1������OԪ�أ�������ϼ�=6-8=-2�������ۺ�����ΪHClO4��
�ʴ�Ϊ��-2��HClO4��
��2�����Ӳ�Խ�����Ӱ뾶Խ���Ӳ���ͬʱ�˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��Cl-��O2-��Mg2+��Al3+��
�ʴ�Ϊ��Cl-��O2-��Mg2+��Al3+��
��3��NԪ�طǽ����Ա�̼��ǿ���ǽ�����Խǿ����������ӦԽ���ף���������������Ӧ�����ף�
�ʴ�Ϊ��N2��
��4���ڡ��ܵ�����������ˮ����ֱ�ΪNaOH��Al��OH��3�����߷�Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪ��Al��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��5���ǽ�����Cl��Br��I���ǽ�����Խǿ����ѧ��Խ�ȶ�������Һ��Խ��������������ӣ�����Խ�������⻯�����ԣ�HI��HBr��HCl��
�ʴ�Ϊ��HI��HBr��HCl��
��6������������˫��ˮ��I-����Ϊ���ʣ�˫��ˮ����ԭΪˮ����Ӧ���ӷ���ʽΪ��2H++H2O2+2I-=2H2O+I2��
�ʴ�Ϊ��2H++H2O2+2I-=2H2O+I2��
���� ���⿼��Ԫ�����ڱ���Ԫ���������ۺ����ã���������Ԫ�������ɱ��Ľṹ��ע��Ի���֪ʶ���������գ�

 �Ķ��쳵ϵ�д�
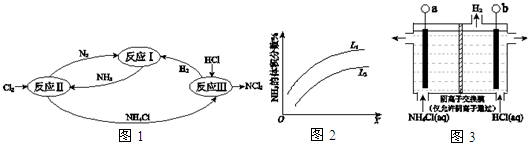
�Ķ��쳵ϵ�д� �������ʹ���������������õ���Ҫ�о�����
�������ʹ���������������õ���Ҫ�о�������1��Ti��BH4��3��һ�ִ�����ϣ�����TiCl4��LiBH4��Ӧ�Ƶã�
�ٻ�̬ԭ��Ti��7��������ͬ�ĵ��ӣ���̬Ti3+��δ�ɶԵ�����1����
��LiBH4��Li+��BH4-���ɣ�BH4-�����幹����sp3�ӻ���LiBH4�в����ڵ�������
��c������ĸ����a�����Ӽ�����b�����ۼ�����c������������d����λ��
��Li��B��HԪ�صĵ縺���ɴ�С����˳��ΪH��B��Li��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϣ�
��LiH�У����Ӱ뾶Li+��H-�����������=����������
��ij��������Ƕ����ڽ���Ԫ��M���⻯�M�IJ��ֵ��������±���ʾ��
| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
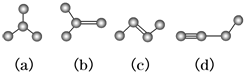
��3�������飨NH3BH3���������Ͻ�LaNix�����������Ĵ�����ϣ�
��H3BNH3�ĵȵ�����Ļ�ѧʽΪC2H6��
�������Ͻ�ľ����ṹʾ��ͼ��ͼ��ʾ��ֻ��1��ԭ��λ�ھ����ڲ�������x=5���������ڸ������ͷ�������ɵ������������壬�������ƽ��ʯ�Ľṹ��Ӳ����С�ڽ��ʯ���������и����У������������岻������c������ĸ����
a����ĥ���ϡ� b���������ߡ� c��������ϡ� d����̽��ͷ��
| A�� | �ڻ������г���+2�� | B�� | ���������ǿ���� | ||
| C�� | ��������ˮ����Ӧ | D�� | ̼����������ˮ |
| Cu��OH��2 | CuOH | CuCl | Cu2O | |
| ��ɫ | ��ɫ | ��ɫ | ��ɫ | ש��ɫ |
| Ksp��25�棩 | 1.6��10-19 | 1.0��10-14 | 1.2��10-6 | - |
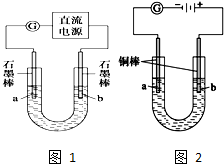
ʵ���װ����ͼ��ʾ����ͨ��Դ����a��b�缫�Ͼ������ݲ�����
��1���������е������ӷ�Ӧ����ʽΪ2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2����
��2��Ϊ��ȷ����Դ���������������в���һ����֮��Ч����BD��
A���۲����������������ɫ
B����U�ι����˷ֱ�������η�̪��Һ
C����ȼ�ŵ�ľ������U�ιܿ�
D����U�ιܿ���һ��ʪ��ĵ���KI��ֽ
ʵ����������װ�õ�ʯī������ͭ������ֱ����Դ���е�⣬װ����ͼ��ʾ��
�۲쵽������������ʾ��
�ٿ�ʼ�������������Һ�����µ�ͭ�������䰵��
��5min��b��������ʼ���ְ�ɫ�������������࣬����a����ɢ��
��10min�����a���İ�ɫ������ʼ��ɺ�ɫ��
��12min��b�������İ�ɫ������ʼ��ɻ�ɫ��Ȼ����ɳȻ�ɫ��
��a��һֱ�д������ݲ�����
��ֹͣ��⣬��U�ι�������Һ����һ��ʱ����ϲ���Һ����ɫ��û�г�����ɫ���²����ȫ����ש��ɫ��
��3��a�������ĵ缫��Ӧ����ʽΪ��2H++2e-=H2������2H2O+2e-�T2OH-+H2������
��4�����5min��b�������ĵ缫��Ӧ����ʽΪ��Cu+Cl--e-�TCuCl����
��5��12min��b���������ֵijȻ�ɫ�����ijɷ���CuOH��Cu2O��ԭ����Ksp��CuOH����Ksp��CuCl����CuClת��Ϊ��ɫ��CuOH������CuOH���ȶ��ֽ�����Cu2O�����ԳȻ�ɫ�����ijɷ�ΪCuOH��Cu2O�Ļ���
| A�� | ﮱ�����ú���� | |
| B�� | Һ�屣���ڴ���Ƥ������ɫϸ�ڲ���ƿ�� | |
| C�� | ���ױ�����ˮ�� | |
| D�� | �ⵥ�ʱ�������ɫ���ƿ�� |
| A�� | CuO | B�� | SiO2 | C�� | Al2O3 | D�� | Fe2O3 |
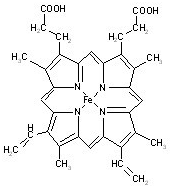 Ѫ������Ѫ�쵰�����ϵ���Ҫ�ȶ��ṹ��ΪѪ�쵰�ס����쵰�ĸ���������ӽṹ��ͼ��
Ѫ������Ѫ�쵰�����ϵ���Ҫ�ȶ��ṹ��ΪѪ�쵰�ס����쵰�ĸ���������ӽṹ��ͼ��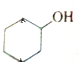 ������3������̼ԭ�ӣ�
������3������̼ԭ�ӣ�