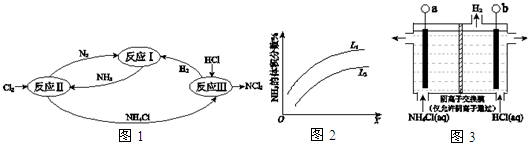
题目内容
7.下列关于离子化合物的叙述正确的是( )| A. | 离子化合物中的阳离子只能是金属离子 | |
| B. | 离子化合物中一定含有离子键 | |
| C. | 离子化合物都能溶于水,其水溶液可以导电 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 A.离子化合物中的阳离子可能为铵根离子;
B.含离子键的一定为离子化合物;
C.离子化合物不一定溶于水;
D.溶于水可以导电的化合物可能为共价化合物.
解答 解:A.离子化合物中的阳离子可能为铵根离子,如铵盐,故A错误;
B.含离子键的一定为离子化合物,离子化合物中一定含离子键,故B正确;
C.离子化合物不一定溶于水,如AgCl、硫酸钡等离子化合物不溶于水,故C错误;
D.溶于水可以导电的化合物可能为共价化合物,如共价化合物HCl的水溶液可导电,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断、常见物质中的化学键为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,只能软化暂时硬水,不能软化永久硬水 | |
| D. | 只具有暂时硬度的水经加热煮沸后,可变成软水 |
15.下列叙述正确的是( )
| A. | 已知常温下0.1mol•L-1NaClO溶液pH为9.7则水解方程式ClOˉ+H2O?HClO+OHˉ的平衡常数K≈10ˉ7.6 | |
| B. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 | |
| D. | 25℃时,pH=4,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
2.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如表所示.已知X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素.下列说法错误的是( )
| X | ||||
| Z | W |
| A. | X和氢组成的化合物分子中可能含有极性共价键和非极性共价键 | |
| B. | 工业上用电解Y和W组成的化合物来制备Y | |
| C. | Z、W两元素的气态氢化物中,W的气态氢化物更稳定 | |
| D. | X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4 |
19.X、Y、Z、R、W是五种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A. | 离子半径:Y2->Z+ | |
| B. | 气态氢化物稳定性:HW>H2R | |
| C. | XW4分子中各原子均满足8电子稳定结构 | |
| D. | Y、Z、R三种元素组成的化合物只含有离子键 |
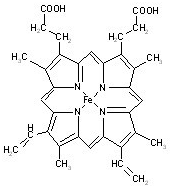 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.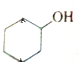 )中有3个手性碳原子.
)中有3个手性碳原子.