题目内容
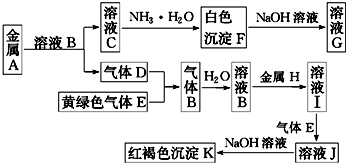
16.硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示.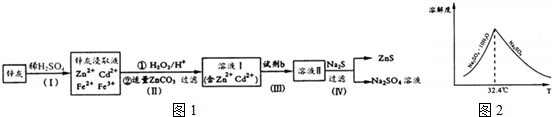
(1)为提高锌灰的浸取率,可采用的方法是①②③⑤(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是Fe(OH)3(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
③已知Na2SO4.10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为
c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为65(Vc-b-d)g.
分析 锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ,和滤渣为Fe(OH)3,步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,据此答题.
解答 解:锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ,和滤渣为Fe(OH)3,步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,
(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,故选①②③⑤;
(2)根据上面的分析可知,步骤Ⅱ所得滤渣中的物质是Fe(OH)3,
故答案为:Fe(OH)3;
(3)根据上面的分析可知,试剂b应为锌,
故答案为:Zn(或锌);
(4)①ZnS固体是从硫酸钠溶液中析出的,所以检验ZnS固体是否洗涤干净的方法是取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净,
故答案为:取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;
②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2,
故答案为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
③根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
故答案为:蒸发浓缩,降温结晶,过滤;
(5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量为cVmol-d mol-b mol,所以锌灰中含有锌元素的质量为65g/mol×(cVmol-d mol-b mol)=65(Vc-b-d)g,
故答案为:65(Vc-b-d)g.
点评 本题为工艺流程题,难度较大,通过从废渣中制取硫化锌的工艺流程,考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等,熟悉物质的性质,清楚流程,是解题关键,侧重学生分析问题、解决问题能力的培养.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | HCl+AgNO3═HNO3+AgCl↓ | B. | Mg+2HCl═MgCl2+H2↑ | ||
| C. | MnO2+4HCl═MnCl2+Cl2↑+2H2O | D. | Au+HNO3+4HCl═HAuCl4+NO↑+2H2O |
| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数大于2NA | |
| B. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的个数必定小于NA | |
| C. | 1mol Cu与含2mol H2SO4,的浓硫酸充分反应,生成的S02的分子个数为NA | |
| D. | 1mol苯分子中含有3NA个碳碳双键 |


 .
. .
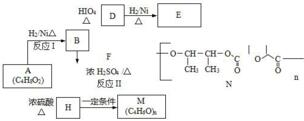
.
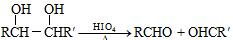
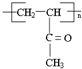 .
.
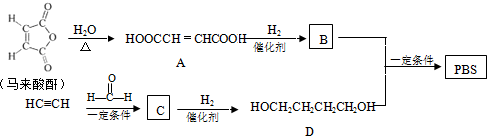
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 →CH≡CH的化学方程式(注明条件)
→CH≡CH的化学方程式(注明条件) 和
和 合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).
合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).