题目内容
6.PBS是一种可降解聚酯类高分子材料 可由马来酸酐等原料经下列路线合成: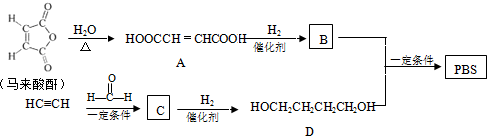
已知:RC≡CH+
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
(1)化合物A中含氧官能团的名称:羧基.
(2)写出C的结构简式HOCH2C≡CCH2OH.
(3)B+D→PBS的反应类型为缩聚反应.
(4)写出满足如下条件的马来酸酐的同分异构体的结构简式:HOOCC≡CCHO.
a.能发生银镜反应;
b.能与NaHCO3反应产生CO2;
c.分子中所有碳原子在同一条直线上
(5)写出
 →CH≡CH的化学方程式(注明条件)
→CH≡CH的化学方程式(注明条件) +2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O.
+2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O.(6)请利用题给出的信息设计由
 和
和 合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).
合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
分析 马来酸酐和水发生加成反应生成A,A和氢气发生加成反应生成B,B为HOOCCH2CH2COOH;
乙炔和甲醛反应生成C,C和氢气发生加成反应生成D,根据D结构简式结合题给信息知,C为HOCH2C≡CCH2OH,B和D反应生成PBS,PBS结构简式为 ,
,
(6)由CH3CH2CH2Br合成CH3CH2 CH2CH2OH,可将CH3CH2CH2Br通过消去、加成、消去生成CH3C≡CH,再用CH3C≡CH与HCHO发生题中信息的反应,最后再催化加氢得产品.
解答 解:马来酸酐和水发生加成反应生成A,A和氢气发生加成反应生成B,B为HOOCCH2CH2COOH;
乙炔和甲醛反应生成C,C和氢气发生加成反应生成D,根据D结构简式结合题给信息知,C为HOCH2C≡CCH2OH,B和D反应生成PBS,PBS结构简式为 ,
,
(1)A中含氧官能团是羧基,故答案为:羧基;
(2)通过以上分析知,C为HOCH2C≡CCH2OH,故答案为:HOCH2C≡CCH2OH;
(3)通过以上分析知,B+D→PBS的反应类型为缩聚反应,故答案为:缩聚反应;
(4)马来酸酐的同分异构体符合下列条件:
a.能发生银镜反应,说明含有醛基;
b.能与NaHCO3反应产生CO2,说明含有羧基;
c.分子中所有碳原子在同一条直线上,
符合条件的同分异构体结构简式为HOOCC≡CCHO,
故答案为:HOOCC≡CCHO;
(5) 和NaOH的醇溶液加热生成CH≡CH,反应方程式为
和NaOH的醇溶液加热生成CH≡CH,反应方程式为 +2NaOH$→_{△}^{乙醇}$CH≡CH
+2NaOH$→_{△}^{乙醇}$CH≡CH
+2NaBr+2H2O,
故答案为: +2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O;
(6)由CH3CH2CH2Br合成CH3CH2 CH2CH2OH,可将CH3CH2CH2Br通过消去、加成、消去生成CH3C≡CH,再用CH3C≡CH与HCHO发生题中信息的反应,最后再催化加氢得产品,具体合成线路为 ,
,
故答案为: .
.
点评 本题考查有机物推断和有机合成,为高频考点,明确物质官能团及其性质关系是解本题关键,难点是有机合成路线的设计,可以根据反应物采用正向思维进行设计也可以根据生成物采用逆向思维进行设计,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| A. | 工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴,溴元素又称“海洋元素” |
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
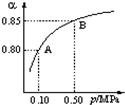
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
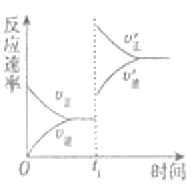
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.
 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式: