题目内容
5.物质A、B、C、D、E、F、G、H、I、J、K存在如图转化关系,其中D、E为气体单质,请回答:(1)写出下列物质的化学式:
A是Al,D是H2,K是Fe(OH)3.
(2)写出反应“C→F”的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)写出反应“F→G”的化学方程式:Al(OH)3+NaOH═NaAlO2+2H2O_
(4)在溶液I中滴入NaOH溶液,可观察到的现象是:先生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色沉淀
(5)J的饱和溶液可以制备胶体用来净水,离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+
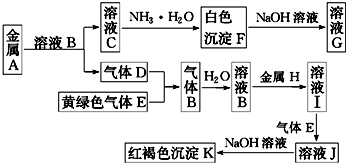
分析 金属A与溶液B反应生成的C肯定为盐,则F为碱,F能与溶液氢氧化钠溶液,则F为应为Al(OH)3,G为NaAlO2,A为Al,黄绿色气体E为Cl2,则D为H2,B为HCl,C为AlCl3,红褐色沉淀K为Fe(OH)3,则H为Fe,I为FeCl2,J为FeCl3,结合对应物质的性质以及题目要求解答该题.
解答 解:金属A与溶液B反应生成的C肯定为盐,则F为碱,F能与溶液氢氧化钠溶液,则F为应为Al(OH)3,G为NaAlO2,A为Al,黄绿色气体E为Cl2,则D为H2,B为HCl,C为AlCl3,红褐色沉淀K为Fe(OH)3,则H为Fe,I为FeCl2,J为FeCl3,
(1)根据上面的分析可知,A为Al,D为H2,K为Fe(OH)3,故答案为:Al;H2;Fe(OH)3;
(2)“C→F”的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)F为Al(OH)3,G为NaAlO2,F→G反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)I为FeCl2,在溶液I中滴入NaOH溶液,生成氢氧化亚铁,氢氧化亚铁不稳定,可被氧化生成氢氧化铁,现象为先生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色沉淀,故答案为:先生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色沉淀;
(5)J为FeCl3,J的饱和溶液可以制备胶体用来净水,离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,难度不大.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
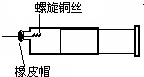 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.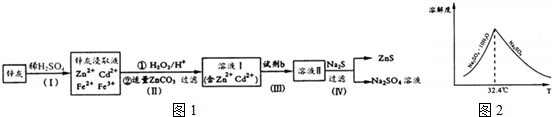
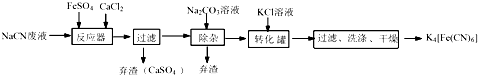
 .
.
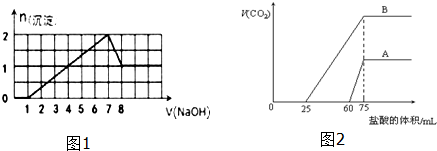
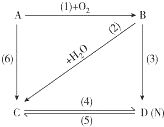 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式: