题目内容
8.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、Cl-、OH-、CO32-、NO3-.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 向该溶液中加入铝粉,只放出H2,则酸溶液中不含NO3-,溶液为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子共存,并结合离子的颜色来解答.
解答 解:无色溶液不含Fe3+,
若为非氧化性酸溶液,则含H+、NH4+、Ba2+、Al3+、Cl-,最多5种,不含OH-、CO32-、NO3-;
若为碱溶液,含Ba2+、Cl-、OH-、NO3-,最多4种,
故选C.
点评 本题考查离子的共存及离子反应,为高频考点,把握与Al反应生成氢气的溶液为非氧化性酸或强碱为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在100mL下列溶液中,分别加入0.05molNaOH固体,溶液的导电能力变化不大的是( )
| A. | 蒸馏水 | B. | 0.5 mol/L的醋酸溶液 | ||
| C. | 0.5 mol/L的盐酸 | D. | 0.5 mol/L的氨水 |
19.下列关于醋酸钠溶液的说法中正确的是( )
| A. | 溶液呈酸性 | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
3.常温下,向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )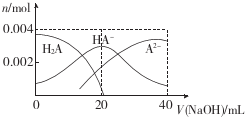

| A. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大 | |
| C. | 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大 | |
| D. | 当V(NaOH)=40 mL时,升高温度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$减小 |
18.缓冲溶液可以抗御少量酸碱对溶液pH的影响.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定.己知在人体正常体温时,反应H2CO3?HCO3-+H+的Ka=10-6.1mol•L-1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3.则下列判断正确的是( )
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
 .
.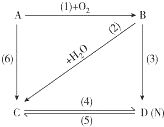 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式: