题目内容
11.用NA表示阿伏加德罗常数值.下列叙述正确的是( )| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
分析 A、1molC6H1206中含有6mol氧原子;
B、Cl2与水的反应为可逆反应;
C、溶液体积不明确;
D、气体所处的状态不明确.
解答 解:A、1molC6H1206中含有6mol氧原子,即6NA个,故A正确;
B、Cl2与水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故B错误;
C、溶液体积不明确,故溶液中氢氧根的个数无法计算,故C错误;
D、气体所处的状态不明确,故其物质的量无法计算,则含有的共用电子对无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
2.已知下述三个实验均能发生化学反应:
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
19.下列关于醋酸钠溶液的说法中正确的是( )
| A. | 溶液呈酸性 | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
6.用1L1.5mol•L-1的氢氧化钠吸收标准状况下22.4LCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为( )
| A. | 1:3 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
3.常温下,向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )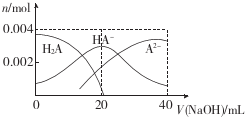

| A. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大 | |
| C. | 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大 | |
| D. | 当V(NaOH)=40 mL时,升高温度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$减小 |
1.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
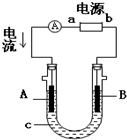 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
 .
.