题目内容
1.常温下,用pH=11的氨水,分别与pH=3的盐酸和某酸等体积混合,得到X、Y两种溶液,关于这两种溶液酸碱性的描述正确的是( )| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
分析 一水合氨为弱碱,氨水的浓度大于0.001mol/L,pH=3的盐酸浓度为0.001mol/L,pH=3的某酸中氢离子浓度为0.001mol/L,酸的浓度≥0.001mol/L;X为氯化铵和氨水的混合液,溶液一定呈碱性,Y溶液酸碱性无法确定,据此进行解答.
解答 解:常温下pH=11的氨水中氢氧根离子浓度为0.001mol/L,氨水浓度大于0.001mol/L,
该氨水与pH=3的盐酸混合,所得溶液X为氨水和氯化铵的混合液,溶液呈碱性,故A、B错误;
pH=3某酸中氢离子浓度为0.001mol/L,若酸为强酸,则氨水过量,Y溶液呈碱性;若该酸为弱酸,Y溶液可能为中性或酸性,故D错误、C正确,
故选C.
点评 本题考查弱电解质的电离平衡及其应用,题目难度不大,明确弱电解质部分电离的特点为解答关键,注意掌握讨论法的应用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.元素周期表可以指导人们进行规律性的推测和判断.下列说法不正确的是( )
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
9.下列化合物中,既有离子键又有共价键的离子化合物是( )
| A. | NH4Cl | B. | MgO | C. | HNO3 | D. | CaCl2 |
16.电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-═ZnO+H2O Ag2O+H2O+2e-═2Ag+2OH-,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
6.下面是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,正确的是( )
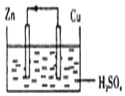

| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
13.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈紫色.如何观察透过蓝色钴玻璃.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈紫色.如何观察透过蓝色钴玻璃.
10.下列对化学键及化合物的分类完全正确的一组是( )
| A. | MgCl2与NaOH均既含离子键又含共价键,均属离子化合物 | |
| B. | BaCO3与H2SO4化学键类型不完全相同,均属强电解质 | |
| C. | 乙醇与醋酸,均只含共价键,均属非电解质 | |
| D. | 氯气与氧气,均只含共价键,均只做氧化剂 |
2. 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.
(1)已知:
若1g水蒸气变为液态水时放出2.4KJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.2kJ/mol.
(2)氢的稳定存储是氢能源发展的关键.固态合金具有较强的吸附氢原子能力,其原理可表示为(以M代表固态合金):2M(s)+xH2(g) $?_{释放}^{存储}$2MHx(s)△H<0
①有利于氢气存储的条件为低温,高压;
②该反应的平衡常数的表达式为$K=\frac{1}{{{c^x}({H_2})}}$;
③达平衡后保持恒温恒压下增加氢气的量,该平衡向右移动(填“向左”、“向右”、或“不”)
(3)储氢合金可做二次电池的电极,其工作原理为:xNi(OH)2+M$?_{放电}^{充电}$MHx+xNiOOH.装置如图所示:
①a为电源的负极;
②写出充电时阴极反应式xH2O+xe-+M=MHx+xOH-;
③以该电池做电源电解饱和NaCl溶液,当手机到标准状况下11.2LH2时,储氢合金理论上释放出1g氢,此时有1molOH-由B向A(填“A”或“B”)移动.
 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.(1)已知:
| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
(2)氢的稳定存储是氢能源发展的关键.固态合金具有较强的吸附氢原子能力,其原理可表示为(以M代表固态合金):2M(s)+xH2(g) $?_{释放}^{存储}$2MHx(s)△H<0
①有利于氢气存储的条件为低温,高压;
②该反应的平衡常数的表达式为$K=\frac{1}{{{c^x}({H_2})}}$;
③达平衡后保持恒温恒压下增加氢气的量,该平衡向右移动(填“向左”、“向右”、或“不”)
(3)储氢合金可做二次电池的电极,其工作原理为:xNi(OH)2+M$?_{放电}^{充电}$MHx+xNiOOH.装置如图所示:
①a为电源的负极;
②写出充电时阴极反应式xH2O+xe-+M=MHx+xOH-;
③以该电池做电源电解饱和NaCl溶液,当手机到标准状况下11.2LH2时,储氢合金理论上释放出1g氢,此时有1molOH-由B向A(填“A”或“B”)移动.