题目内容
10.下列对化学键及化合物的分类完全正确的一组是( )| A. | MgCl2与NaOH均既含离子键又含共价键,均属离子化合物 | |
| B. | BaCO3与H2SO4化学键类型不完全相同,均属强电解质 | |
| C. | 乙醇与醋酸,均只含共价键,均属非电解质 | |
| D. | 氯气与氧气,均只含共价键,均只做氧化剂 |
分析 一般来说,活泼非金属元素与活泼金属元素之间形成离子键,非金属元素之间形成共价键,在水溶液中或熔融状态下能导电的化合物是电解质,据此分析.
解答 解:A.MgCl2中只含有离子键,NaOH中既含离子键又含共价键,二者均属离子化合物,故A错误;
B.BaCO3中含有离子键和共价键,H2SO4只含有共价键,化学键类型不完全相同,二者均属强电解质,故B正确;
C.乙醇与醋酸,均只含共价键,乙醇属于非电解质,醋酸属于电解质,故C错误;
D.氯气与氧气,均只含共价键,氯气与水反应时,氯气既是氧化剂又是还原剂,故D错误.
故选B.
点评 本题考查了化学键、电解质、氧化还原反应,题目难度不大,侧重于基础知识的考查,注意把握电解质和非电解质、强电解质和弱电解质的判断方法.

练习册系列答案
相关题目
20.如图是课外活动小组设计的用化学电源使LED灯发光装置.下列说法不正确的是( )
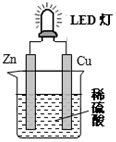

| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
1.常温下,用pH=11的氨水,分别与pH=3的盐酸和某酸等体积混合,得到X、Y两种溶液,关于这两种溶液酸碱性的描述正确的是( )
| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
18.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10 NA | |
| B. | 22.4 LC02中含有共价键数目4 NA | |
| C. | 若H2O2分解产生成0.1mol氧气转移的电子数为0.2 NA | |
| D. | 同温、同压同体积的CO和NO含有的电子数相等 |
5.下面有关晶体的叙述中,不正确的是( )
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数) | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
15.下列物质全部属于纯净物的是( )
| A. | 甘油、氯仿、乙醇钠 | B. | 福尔马林、葡萄糖、乙酸乙酯 | ||
| C. | 苯、汽油、乙二酸 | D. | 甘氨酸、聚氯乙烯、苯酚 |
2.烷烃的相对分子质量为72,跟氯气发生取代反应所得的一氯代物只1种,该烃是( )
| A. | CH3CH2CH2CH2CH3 | B. |  | ||
| C. |  | D. |  |
10.二氧化碳重整甲烷不仅可以获得合成气(CO和H2)还可减少温室气体排放.回答下列问题:
(1)已知断裂1mol化学键所需的能量如表:(CO的化学键近似表示为CO):
则反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+238KJ/molkJ•mol-1.
(2)在T℃时,向恒温4L的密闭容器中通入6mol CO2、6mol CH4,在催化剂作用下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).达平衡时H2的体积分数为0.4,若再向容器中同时充入2mol CO2、6molCH4、4molCO和8molH2,则上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
(3)CH4/CO2重整反应通过热力学计算可得到的图象之一如图1.实际生产中有C、H2O(g)等生成,生成碳的反应之一为CH4(g)?C(s)+2H2(g),600℃之后,C的物质的量减少,请用方程式表示C减少的原因C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO.
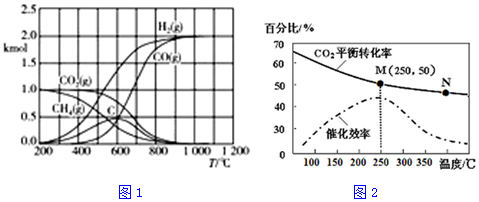
(4)不同温度对CO2的转化率及催化剂的效率影响如图2所示,下列有关说法不正确的是①②④(填序号).
①不同条件下反应,N点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知某温度下CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数为K1
H2O(g)+CH4(g)?CO(g)+3H2(g)的平衡常数为K2
C(s)+H2O(g)?2CO(g)+2H2(g)的平衡常数为K3
则反映C(g)+CO2(g)?2CO(g) 的平衡常数为K为$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$(用K1、K2、K3表示)
(1)已知断裂1mol化学键所需的能量如表:(CO的化学键近似表示为CO):
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
(2)在T℃时,向恒温4L的密闭容器中通入6mol CO2、6mol CH4,在催化剂作用下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).达平衡时H2的体积分数为0.4,若再向容器中同时充入2mol CO2、6molCH4、4molCO和8molH2,则上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
(3)CH4/CO2重整反应通过热力学计算可得到的图象之一如图1.实际生产中有C、H2O(g)等生成,生成碳的反应之一为CH4(g)?C(s)+2H2(g),600℃之后,C的物质的量减少,请用方程式表示C减少的原因C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO.

(4)不同温度对CO2的转化率及催化剂的效率影响如图2所示,下列有关说法不正确的是①②④(填序号).
①不同条件下反应,N点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知某温度下CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数为K1
H2O(g)+CH4(g)?CO(g)+3H2(g)的平衡常数为K2
C(s)+H2O(g)?2CO(g)+2H2(g)的平衡常数为K3
则反映C(g)+CO2(g)?2CO(g) 的平衡常数为K为$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$(用K1、K2、K3表示)
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.