题目内容
2. 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.(1)已知:
| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
(2)氢的稳定存储是氢能源发展的关键.固态合金具有较强的吸附氢原子能力,其原理可表示为(以M代表固态合金):2M(s)+xH2(g) $?_{释放}^{存储}$2MHx(s)△H<0
①有利于氢气存储的条件为低温,高压;
②该反应的平衡常数的表达式为$K=\frac{1}{{{c^x}({H_2})}}$;
③达平衡后保持恒温恒压下增加氢气的量,该平衡向右移动(填“向左”、“向右”、或“不”)
(3)储氢合金可做二次电池的电极,其工作原理为:xNi(OH)2+M$?_{放电}^{充电}$MHx+xNiOOH.装置如图所示:
①a为电源的负极;
②写出充电时阴极反应式xH2O+xe-+M=MHx+xOH-;
③以该电池做电源电解饱和NaCl溶液,当手机到标准状况下11.2LH2时,储氢合金理论上释放出1g氢,此时有1molOH-由B向A(填“A”或“B”)移动.
分析 (1)燃烧热是指在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量;
(2)①有利于储存氢气即将游离态的氢气转化为化合态,即使平衡向正反应方向进行;
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
③根据浓度对化学平衡移动的影响来回答;
(3)①Ni(OH)2中的O元素由-2价升高到-1价,作还原剂发生氧化反应,作电解池的阳极,阳极与电源相连的是正极,故M为阴极,与电源相连的是负极;
②由①分析得阴极材料为M,得电子发生还原反应,据此书写电极方程式;
③m=nM进行计算,据得失电子守恒计算;阴离子移向阳极.
解答 解:(1)在反应H2(g)+$\frac{1}{2}$O2(g)=H2O(g)中,断裂1molH-H键,$\frac{1}{2}$molO≡0键共吸收的能量为1×436kJ+$\frac{1}{2}×$496kJ=684kJ,生成1molH2O,共形成2molO-H键,放出的能量为2×463kJ=926kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为926kJ-684kJ=242kJ,O2与H2反应生成H2O(g)的热化学方程式为,H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1①,1g水蒸气变为液态水时放出2.4KJ热量,则18g水蒸气即1mol变为液态水时放出43.2KJ热量,故热化学方程式为H2O(g)=H2O(l)△H=-43.2kJ•mol-1②,①+②得,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.2kJ•mol-1,故氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.2kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.2kJ/mol;
(2)①有利于储存氢气即将游离态的氢气转化为化合态,即使平衡向正反应方向进行,正反应是放热反应是气体体积减小的反应,故为低温,高压,能使平衡向正反应方向进行,
故答案为:低温,高压;
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故:
可逆反应2M(s)+xH2(g) $?_{释放}^{存储}$2MHx(s) 的平衡常数$K=\frac{1}{{{c^x}({H_2})}}$,
故答案为:$K=\frac{1}{{{c^x}({H_2})}}$;
③平衡后加入一定量氢气,氢气浓度增大,正反应速率增大,平衡向右移动,
故答案为:向右;
(3)①Ni(OH)2中的O元素由-2价升高到-1价,作还原剂发生氧化反应,作电解池的阳极,阳极与电源相连的是正极,故M为阴极,与电源相连的是负极,
故答案为:负;
②由①分析得阴极材料为M,得电子发生还原反应,故电极方程式为xH2O+xe-+M=MHx+xOH-,
故答案为:xH2O+xe-+M=MHx+xOH-;
③m=nM=$\frac{11.2L}{22.4L/mol}×2g/mol$=1g;生成1molH2转移2mol电子,则生成1gH2即0.5mol,转移1mol电子,根据得失电子守恒,即M得到1mol电子,故电极方程式为H2O+e-+M=MH+OH-,则生成1molOH-;阴离子移向阳极,故由B到A,
故答案为:1;1;B;A.
点评 本题考查燃烧热化学方程式的书写,平衡移动的判断,电极方程式的书写,平衡常数的计算等,本题难度中等.

| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
| A. | CH3CH2CH2CH2CH3 | B. |  | ||
| C. |  | D. |  |
(1)已知断裂1mol化学键所需的能量如表:(CO的化学键近似表示为CO):
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
(2)在T℃时,向恒温4L的密闭容器中通入6mol CO2、6mol CH4,在催化剂作用下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).达平衡时H2的体积分数为0.4,若再向容器中同时充入2mol CO2、6molCH4、4molCO和8molH2,则上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
(3)CH4/CO2重整反应通过热力学计算可得到的图象之一如图1.实际生产中有C、H2O(g)等生成,生成碳的反应之一为CH4(g)?C(s)+2H2(g),600℃之后,C的物质的量减少,请用方程式表示C减少的原因C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO.
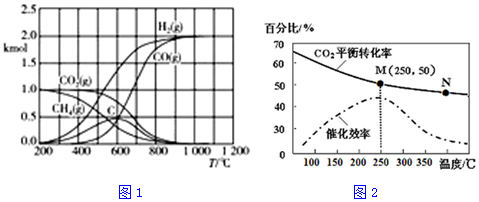
(4)不同温度对CO2的转化率及催化剂的效率影响如图2所示,下列有关说法不正确的是①②④(填序号).
①不同条件下反应,N点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知某温度下CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数为K1
H2O(g)+CH4(g)?CO(g)+3H2(g)的平衡常数为K2
C(s)+H2O(g)?2CO(g)+2H2(g)的平衡常数为K3
则反映C(g)+CO2(g)?2CO(g) 的平衡常数为K为$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$(用K1、K2、K3表示)
| 实验目的 | 实验操作 | |
| A | 区分苯和四氯化碳 | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡 |
| B | 证明溴乙烷中有溴原子 | 溴乙烷与NaOH水溶液共热,充分反应,冷却后加入硝酸银溶液 |
| C | 制取溴苯 | 在苯中加铁粉后再加溴水并振荡 |
| D | 除去苯中的甲苯 | 向混合物中加入酸性高锰酸钾溶液,然后分液 |
| A. | A | B. | B | C. | C | D. | D |
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.