题目内容
1.在常温下,下列溶液中有关微粒浓度的关系正确的是( )| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
分析 A.不考虑离子水解,硫酸根离子浓度和铵根离子浓度相同,都大于亚铁离子浓度,铵根离子水解减小,小于硫酸根离子浓度;
B.常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合,一水合氨是弱碱存在电离平衡,混合后一水合氨又电离出氢氧根离子,溶液显碱性;
C.Na2CO3溶液中存在物料守恒,n(Na)=2n(C);
D.溶液中存在电荷守恒分析判断.
解答 解:A.不考虑离子水解,硫酸根离子浓度和铵根离子浓度相同,都大于亚铁离子浓度,铵根离子水解减小,小于硫酸根离子浓度,0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;
B.常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合,一水合氨是弱碱存在电离平衡,混合后一水合氨又电离出氢氧根离子,溶液显碱性,溶液中c(NH4+)<c(Cl-),故B错误;
C.Na2CO3溶液中存在物料守恒,n(Na)=2n(C),c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.溶液中存在电荷守恒,某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、酸碱混合反应后溶液酸碱性判断、弱电解质电离平衡影响因素、物料守恒和电荷守恒的分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
11.下列说法正确的是( )
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 苯酚如不慎沾到皮肤上,应立即用酒精洗涤 | |
| C. | 乙酸乙酯与稀硫酸混合水浴加热,酯层完全消失 | |
| D. | 向2mL10%硫酸铜溶液滴加4~6滴2%氢氧化钠溶液中,再加入0.5mL乙醛溶液加热,有红色沉淀出现 |
9.下列事实中,能说明HNO2是弱电解质的是( )
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol•L-1HNO2溶液的pH为3 |
16.下列有关反应的离子方程式正确的是( )
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 明矾可用于净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | HCO3-的水解方程式为:HCO3-+H2O═CO32-+H3O+ |
13.有机物的分子式为C3H6O2,以下说法正确的是( )
| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
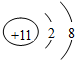 ;
;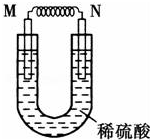 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.