题目内容
11.下列说法正确的是( )| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 苯酚如不慎沾到皮肤上,应立即用酒精洗涤 | |
| C. | 乙酸乙酯与稀硫酸混合水浴加热,酯层完全消失 | |
| D. | 向2mL10%硫酸铜溶液滴加4~6滴2%氢氧化钠溶液中,再加入0.5mL乙醛溶液加热,有红色沉淀出现 |
分析 A、银单质与氨水不反应;
B、苯酚易用于酒精;
C、酯类在酸性条件下的水解是可逆反应;
D、配制氢氧化铜悬浊液时,使用的氢氧化钠溶液必须过量.
解答 解:A、银单质与氨水不反应,可用稀硝酸洗去,故A错误;
B、苯酚有毒,且苯酚易用于酒精,故可以用酒精洗去沾在皮肤上的苯酚,故B正确;
C、酯类在酸性条件下的水解是可逆反应,不能水解彻底,故酯类不能完全消失,故C错误;
D、配制氢氧化铜悬浊液时,使用的氢氧化钠溶液必须过量,而向2mL10%硫酸铜溶液滴加4~6滴2%氢氧化钠溶液,NaOH的量不足,故加入乙醛溶液,实验会失败,不会有红色沉淀出现,故D错误.
故选B.
点评 本题考查化学实验基本操作和实验危险的处理以及实验操作的要点,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
2. 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.
(1)居民使用的管道煤气主要成分是H2、CO和少量CH4,H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
天然气已经成为城市居民使用的主要生活能源.使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大空气(填“空气”或“天然气”)的进入量或减少天然气(填“空气”或“天然气”)的进入量.1m3(标准状况)甲烷在25℃,101kPa时,充分燃烧生成二氧化碳气体和液态水时释放的热能是3.97×104kJ.
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
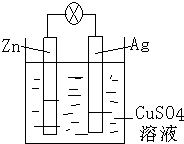
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,该原电池的总反应离子方程式为Zn+Cu2+=Cu+Zn2+.
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.(1)居民使用的管道煤气主要成分是H2、CO和少量CH4,H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,该原电池的总反应离子方程式为Zn+Cu2+=Cu+Zn2+.
19.某同学学习过元素周期律、元素周期表后,在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管;胶头滴管.(请填写两件主要的玻璃仪器)
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在如表横线中填写相关内容):
(4)实验结论:同一主族,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举事实说明氟的非金属性比氯强HF的稳定性强于HCl;F2能置换出水中的氧,而Cl2不能置换出水中的氧.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管;胶头滴管.(请填写两件主要的玻璃仪器)
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在如表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举事实说明氟的非金属性比氯强HF的稳定性强于HCl;F2能置换出水中的氧,而Cl2不能置换出水中的氧.
6.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
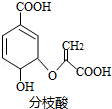

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有3种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
16.下列表中括号内的物质为所含的少量杂质,请选用最佳试剂和分离方法将杂质除去.
| 需加入的试剂 | 分离方法 | |
| 乙烷(乙烯) | ||
| 乙醇(水) | ||
| 苯(苯酚) |
3.下列化学用语正确的是( )
| A. | 二氧化碳分子的电子式: | B. | HClO的结构式为 H-Cl-O | ||
| C. | 硅的原子结构示意图: | D. | 甲烷分子的比例模型: |
20.下列推断正确的是( )
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
1.在常温下,下列溶液中有关微粒浓度的关系正确的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |