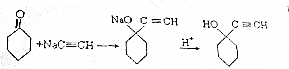题目内容
9.下列事实中,能说明HNO2是弱电解质的是( )| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol•L-1HNO2溶液的pH为3 |
分析 部分电离、溶液中存在电离平衡的电解质为弱电解质,要证明亚硝酸为弱电解质,只要证明亚硝酸部分电离即可,据此分析解答.
解答 解:A.亚硝酸溶液用水稀释后氢离子浓度下降,因为溶液体积增大,即使亚硝酸是强电解质,溶液中氢离子浓度也减小,则不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故A错误;
B.溶液导电性与离子浓度成正比,HNO2溶液的导电性比盐酸弱,说明亚硝酸中离子浓度小于盐酸,则不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故B错误;
C.亚硝酸不能和氯化钠反应,说明不具备复分解反应条件,不能说明亚硝酸部分电离,则不能说明亚硝酸是弱电解质,故C错误;
D.常温下,0.1mol•L-1HNO2溶液的pH为3,溶液中氢离子浓度小于酸浓度,则酸部分电离,为弱电解质,故D正确;
故选D.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,电解质强弱与电解质溶液导电性强弱无关,为易错点.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
19.某同学学习过元素周期律、元素周期表后,在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管;胶头滴管.(请填写两件主要的玻璃仪器)
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在如表横线中填写相关内容):
(4)实验结论:同一主族,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举事实说明氟的非金属性比氯强HF的稳定性强于HCl;F2能置换出水中的氧,而Cl2不能置换出水中的氧.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管;胶头滴管.(请填写两件主要的玻璃仪器)
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在如表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举事实说明氟的非金属性比氯强HF的稳定性强于HCl;F2能置换出水中的氧,而Cl2不能置换出水中的氧.
20.下列推断正确的是( )
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
4.表 列出了A~R十种元素在周期表的位置:
(1)在所示十种元素中,最活泼的金属元素是K.(均填元素符号)
(2)在所示十种元素中,原子半径最小的是O,原子半径最大的是K.(均填元素符号)
(3)C元素在周期表中的位置:第三周期IIA族.
(4)写出EF2分子的电子式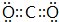 .
.
(5)H、I、G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为HClO4>H2SO4>H2SiO3.(填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 4NO2↑+CO2↑+2 H2O.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
(2)在所示十种元素中,原子半径最小的是O,原子半径最大的是K.(均填元素符号)
(3)C元素在周期表中的位置:第三周期IIA族.
(4)写出EF2分子的电子式
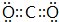 .
.(5)H、I、G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为HClO4>H2SO4>H2SiO3.(填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 4NO2↑+CO2↑+2 H2O.
14.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
1.在常温下,下列溶液中有关微粒浓度的关系正确的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |