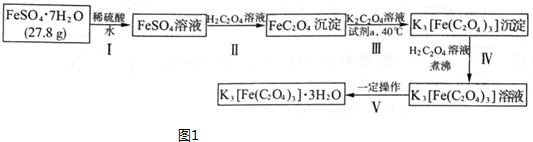
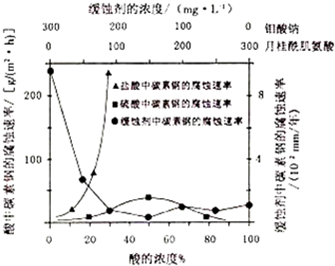
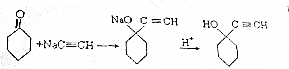题目内容
12.根据给定条件,写出下列反应的离子方程式(1)①向Ca(HCO3)2溶液中加入少量NaOH溶液,请写出发生反应的离子方程式Ca2++HCO3-+OH-=CaCO3↓+H2O
②向Ca(HCO3)2溶液中加入过量NaOH溶液,请写出发生反应的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
(2)已知:氧化性 Br2>Fe3+;在含有n mol FeBr2的溶液中,通入Cl2的物质的量为X.
①当X≤0.5n mol时,这一反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-
②当X≥1.5n mol时,这一反应的离子方程式是2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③当X=n mol时,这一反应的离子方程式是2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
④在2mol/L FeBr2 溶液80mL中通入4.48L标况下的氯气,充分反应,对应的离子方程式是4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-.
分析 (1)向Ba(HCO3)2溶液中滴加少量的NaOH溶液,氢氧化钠全反应,按氢氧根全反应来书写,若滴加过量的NaOH溶液,则钡离子和碳酸氢根按照1:2来反应;
(2)根据题目信息,氧化性:Cl2>Br2>Fe3+,氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,先氧化亚铁离子,亚铁离子钡氧化完后再氧化溴离子,根据相关量定量书写方程式.
解答 解:(1)根据少定多变法书写,Ca(HCO3)2溶液和少量的NaOH溶液发生反应的离子方程式为:Ca2++HCO3-+OH-═BaCO3↓+H2O,和过量的NaOH溶液发生反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故答案为:Ca2++HCO3-+OH-═CaCO3↓+H2O;Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O;
(2)根据题目信息,氧化性:Cl2>Br2>Fe3+,氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,先氧化亚铁离子,亚铁离子钡氧化完后再氧化溴离子,①当氯气只氧化二甲铁离子时,反应为2Fe2++Cl2=2Fe3++2Cl-,②氯气按比例氧化部分溴离子时2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,③氯气将两个离子全部氧化时2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,根据比例关系知,当x≤0.5n时,氯气只氧化二价铁,当0.5n<x<1.5n,二价铁全部被氧化,溴离子部分被氧化,当x≥1.5n,溴离子全部被氧化,故答案为:①2Fe2++Cl2=2Fe3++2Cl-;②2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;③2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;④4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-.
点评 本题考查学生离子方程式的定量书写,要求掌握氧化还原的基础知识,熟悉氧化性还原性相对强弱顺序,难度较大.

| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL.试回答下列问题:
(1)锥形瓶中的溶液从红色色变为无色 色时,停止滴定.
(2)该小组在步骤①中的错误是将锥形瓶用蒸馏水洗净后,又用待测溶液润洗锥形瓶2~3次,由此造成的测定结果偏高(偏高、偏低或无影响).
根据下列数据:请计算待测烧碱溶液的浓度为:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
I.按如图1装置用H2还原无水FeCl3制取.
(1)装置C的作用是干燥氢气;E中盛放的试剂是碱石灰;D中反应的化学方程式为H2+2FeCl3=2FeCl2+2HCl.
(2)温度控制不当,产品中含单质铁.检验产品中是否含铁的方案是取样,加入盐酸中,观察是否有气泡产生.
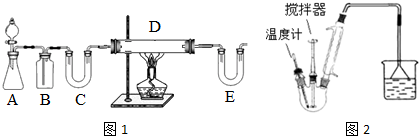
II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128~139℃加热3h,反应接近100%.冷却,分离提纯得到粗产品.反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
(3)该制取反应中,作还原剂的是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品.
①洗涤所用的试剂可以是苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过90%,则烧杯中加入的试剂可以是滴有酚酞且含18gNaOH的溶液.