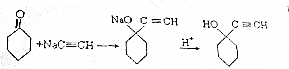题目内容
13.有机物的分子式为C3H6O2,以下说法正确的是( )| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
分析 有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,该物质结构简式可能为HOCH2CH=CHCH2OH、CH3CH2COOH、HCOOCH2CH3、CH3COOCH3、HOCH2CH2CHO等,根据醇、烯烃、羧酸、酯、醛等物质的性质分析解答.
解答 解:A.有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,该物质结构简式可能为HOCH2CH=CHCH2OH、CH3CH2COOH、HCOOCH2CH3、CH3COOCH3、HOCH2CH2CHO等,如果为醛和醇,能发生氧化反应,故A错误;
B.能水解生成甲醇的有CH3COOCH3,水解生成甲酸的有HCOOCH2CH3,所以只有两种,故B错误;
C.能和NaOH溶液反应的有酯和羧酸,为CH3CH2COOH、HCOOCH2CH3、CH3COOCH3,有3种物质能和NaOH溶液反应,故C错误;
D.有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,所以该分子中一定含有碳碳双键或碳氧双键,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,正确判断该物质结构特点是解本题关键,注意不饱和度的计算方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列化学用语正确的是( )
| A. | 二氧化碳分子的电子式: | B. | HClO的结构式为 H-Cl-O | ||
| C. | 硅的原子结构示意图: | D. | 甲烷分子的比例模型: |
4.表 列出了A~R十种元素在周期表的位置:
(1)在所示十种元素中,最活泼的金属元素是K.(均填元素符号)
(2)在所示十种元素中,原子半径最小的是O,原子半径最大的是K.(均填元素符号)
(3)C元素在周期表中的位置:第三周期IIA族.
(4)写出EF2分子的电子式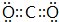 .
.
(5)H、I、G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为HClO4>H2SO4>H2SiO3.(填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 4NO2↑+CO2↑+2 H2O.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
(2)在所示十种元素中,原子半径最小的是O,原子半径最大的是K.(均填元素符号)
(3)C元素在周期表中的位置:第三周期IIA族.
(4)写出EF2分子的电子式
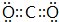 .
.(5)H、I、G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为HClO4>H2SO4>H2SiO3.(填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 4NO2↑+CO2↑+2 H2O.
1.在常温下,下列溶液中有关微粒浓度的关系正确的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
8.下列各组离子在指定的溶液中可能大量共存的是( )
| A. | 透明的溶液中:Na+、Cu2+、SO42-、Cl- | |
| B. | pH=1的溶液中:Al3+、Mg2+、S2O32-、AlO2- | |
| C. | 能使酚酞变红色的溶液中:Fe3+、Ba2+、HC2O4-、Cl- | |
| D. | 常温下,水电离的c(OH-)=1×10-12mol•L-1溶液中:NH4+、Fe2+、SO42-、NO3- |
7.某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL.试回答下列问题:
(1)锥形瓶中的溶液从红色色变为无色 色时,停止滴定.
(2)该小组在步骤①中的错误是将锥形瓶用蒸馏水洗净后,又用待测溶液润洗锥形瓶2~3次,由此造成的测定结果偏高(偏高、偏低或无影响).
根据下列数据:请计算待测烧碱溶液的浓度为:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL.试回答下列问题:
(1)锥形瓶中的溶液从红色色变为无色 色时,停止滴定.
(2)该小组在步骤①中的错误是将锥形瓶用蒸馏水洗净后,又用待测溶液润洗锥形瓶2~3次,由此造成的测定结果偏高(偏高、偏低或无影响).
根据下列数据:请计算待测烧碱溶液的浓度为:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |