题目内容
8.乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
已知:H2O(l)═H2O(g)△H2=+b kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-(a+3b-2c)kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O(g)?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
②T℃时,向2L密闭容器中投入2.00molCH4和2.00mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.333mol•L-1,则T=1100℃,该温度下达到平衡时H2的平均生成速率为0.400mol/(L•h)(保留3位有效数字).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
用CxHy(烃)催化还原NOx可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.
固体电解质里O2-的移动方向是向负极(填“正极”或“负极”)移动,该电池负极的电极反应式为C2H6O+6O2--12e-=2CO2+3H2O.
分析 (1)①2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
②H2O(l)═H2O(g)△H2=+b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1,
①-2×③-3×②得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),依据盖斯定律计算反应热;
(2)①升高温度,平衡向吸热方向移动,吸热方向平衡常数增大;
②列三段,根据平衡常数表达式计算其数值;依据V=$\frac{△c}{△t}$计算氢气的生成速率;
(3)CH4与NO2发生反应生成无毒的N2、CO2和H2O;
(4)原电池阴离子移向负极;燃料电池中负极燃料乙醇失去电子发生氧化反应生成二氧化碳和水;
解答 解:(1)①2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
②H2O(l)═H2O(g)△H2=+b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1,
①-2×③-3×②得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),依据盖斯定律该反应的反应热为:△H1-3△H2-2△H3=-(a+3b-2c)kJ•mol-1;
故答案为:-(a+3b-2c)kJ•mol-1;
(2)①依据图中数据可知,温度升高,K增大,平衡向正向移动,升高温度平衡向吸热方向移动,则正向为吸热反应;
故答案为:吸热;
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,则:
CH4+H2O(g)?CO+3H2,
起始浓度:(mol/L) 1 1 0 0
转化浓度:(mol/L) $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ 2
平衡浓度:(mol/L) $\frac{1}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ 2
该温度K=$\frac{[CO]•[{H}_{2}]^{3}}{[C{H}_{4}]•[{H}_{2}O]}$=$\frac{\frac{2}{3}×{2}^{3}}{\frac{1}{3}×\frac{1}{3}}$=48mol2/L2,所以该温度为:1100;
V(H2)=$\frac{2mol/L}{5h}$=0.400mol/(L•h);
故答案为:1100℃0.400mol/(L•h);
(3)CH4与NO2发生反应生成无毒的N2、CO2和H2O,反应为CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
故答案为:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O;
(4)原电池阴离子移向负极;通入乙醇一极是负极,该极上乙醇失去电子发生氧化反应生成二氧化碳和水,电极反应式为C2H6O+6O2--12e-=2CO2+3H2O;
故答案为:负;C2H6O+6O2--12e-=2CO2+3H2O.
点评 本题为综合题,考查了反应热的计算、化学平衡常数的计算及应用、燃料电池电极反应式的书写,题目综合性较强,难度中等.

| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:
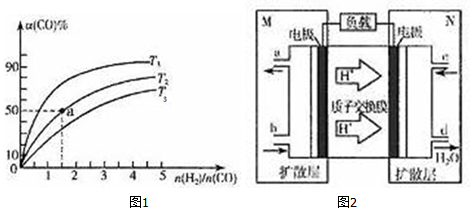
①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.4mol.
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(4)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(写出两种).
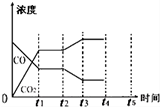
(6)若该容器绝热体积不变,不能判断反应达到平衡的是②③.
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)逆.
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:
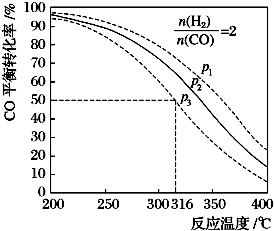
则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .
| A. | 32gO2和32gO3所含原子数目都为2NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1 mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 |
 .
.