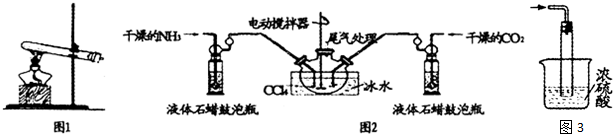
题目内容
12.已知某温度下,四种一元弱酸的电离平衡常数为:物质的量浓度都为0.1mol•L-1的下列溶液中,pH最小的是( )| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
分析 同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱,从而得到pH的大小.
解答 解:同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是HF,最弱的是HCN,则pH最小的是酸性最强的,即HF,故选C.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸性强弱的关系是解本题关键,难度不大.

练习册系列答案
相关题目
2.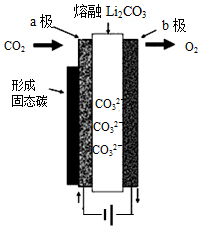 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
3.下列说法中,正确的是( )
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
20.在无土栽培中,需配制一定组成的植物营养液.已知某植物营养液的配方为0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1LH2O.若以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,需三种溶质的物质的量为( )
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
9.工业上利用废铜屑制备胆矾的工业流程如下:
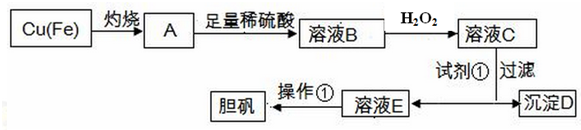
已知:
请回答:
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).

已知:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).
7.(1)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加Fe和H2SO4试剂(填化学式)
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
则该醋酸溶液的准确浓度为0.2000mol/L.(保留小数点后四位)
(3)丙同学利用:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定.
①设计的下列滴定方式,最合理的是b.(夹持部分略去)(填字母序号)
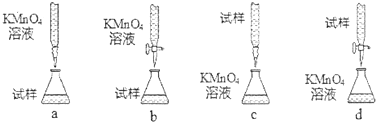
②判断滴定终点的依据是当滴下最后一滴KMnO4标准溶液时,溶液颜色变为浅紫红色,且在半分钟内不褪色.
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(3)丙同学利用:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定.
①设计的下列滴定方式,最合理的是b.(夹持部分略去)(填字母序号)

②判断滴定终点的依据是当滴下最后一滴KMnO4标准溶液时,溶液颜色变为浅紫红色,且在半分钟内不褪色.