题目内容
4.25℃,101k Pa时,强酸与强/碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
分析 A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,醋酸是弱酸,电离要吸热;
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量;
C、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
D、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量,反应热与化学计量数成正比.
解答 解:A、因醋酸是弱酸,电离要吸热,所以该反应的反应热△H不是-57.3kJ/mol,故A错误;
B、反应是放热反应,焓变为负值,不符合中和热的概念,故B错误;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D、热化学方程式中是2mol物质燃烧,所以热化学方程式为:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ/mol,故D正确;
故选D.
点评 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键,注意知识的熟练掌握.

练习册系列答案
相关题目
9.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是( )
| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
10.下列反应的能量变化与其他三项不相同的是( )
| A. | 甲烷燃烧 | B. | 碳酸钙高温分解 | ||
| C. | 锌片与稀硫酸反应 | D. | 钠与冷水反应 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
14.在某无色透明的强碱性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
9.工业上利用废铜屑制备胆矾的工业流程如下:
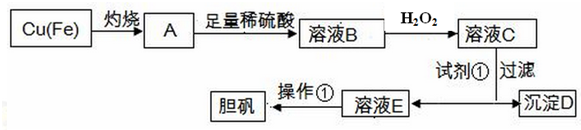
已知:
请回答:
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).

已知:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).
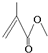 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.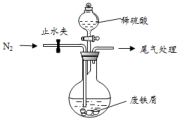 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: