题目内容
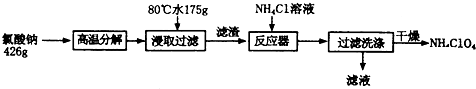
16.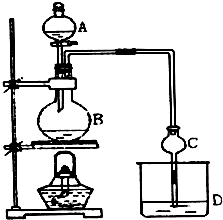 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.仔细观察溶液D中会有少量气泡产生,试用离子方程式解释产生此现象的原因是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:C2H5OH+2H2SO4→2C+2SO2↑+5H2O.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集77.1℃ 左右的馏分,以得较纯净的乙酸乙酯.
分析 (1)仪器A的名称为分液漏斗;乙酸与乙醇在浓硫酸作催化剂、加热的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
(2)圆底烧瓶受热不均,球形干燥管的管口伸入液面下可能发生倒吸,同时起冷凝作用;
醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,溶解挥发出来的乙醇,反应掉挥发出来的乙酸放出二氧化碳气体,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
(3)装置B中溶液变成了棕黑色,则生成碳,说明浓硫酸将乙醇氧化成碳;
(4)根据乙酸乙酯的沸点判断温度.
解答 解:(1)仪器A的名称为分液漏斗;乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,由于反应加入的是乙酸钠,故浓硫酸还制乙酸的作用,故浓硫酸的作用为:制乙酸、催化剂、吸水剂,羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
故答案为:制乙酸、催化剂、吸水剂;分液漏斗;CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
(2)圆底烧瓶受热不均,球形干燥管的管口伸入液面下可能发生倒吸,球形干燥管体积大,可以防止倒吸,同时起冷凝作用;
用饱和碳酸钠溶液吸收乙酸乙酯,溶解挥发出来的乙醇,反应掉挥发出来的乙酸放出二氧化碳气体,所以D中会有少量气泡产生的离子方程式为:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;
故答案为:防止倒吸、冷凝;2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;
(3)浓H2SO4具有强氧化性,将乙醇氧化成碳,所以装置B中溶液变成了棕黑色,反应的化学方程式为:C2H5OH+2H2SO4→2C+2SO2↑+5H2O,故答案为:C2H5OH+2H2SO4→2C+2SO2↑+5H2O;
(4)乙酸乙酯的沸点为77.1℃,所以收集 77.1℃左右的馏分,以得较纯净的乙酸乙酯,故答案为:77.1℃.
点评 本题考查乙酸乙酯的制备与实验改进,难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用.

| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.①检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶C.水D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
试回答:在右试管中通常加入饱和碳酸钠溶液.作用是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
反应中加入浓硫酸的作用是催化剂、吸水剂.
| A. | CO2 | B. | HCl | C. | BaSO4 | D. | NaOH溶液 |
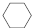 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$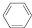 (g)+3H2(g).
(g)+3H2(g).
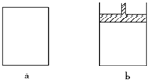 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应: