题目内容
1.高氯酸铵可用于火箭推进剂,实验室可由NaClO.等原料制取(部分物质溶解度如图1),其实验流程如下: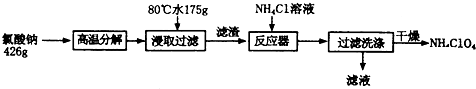
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl.
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为NaClO4(写化学式).
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为NH4++ClO4-=NH4ClO4.
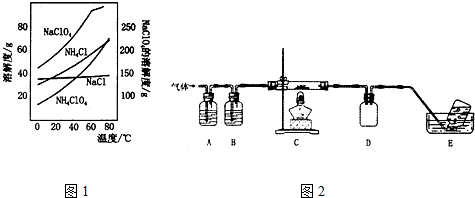
(4)已知:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
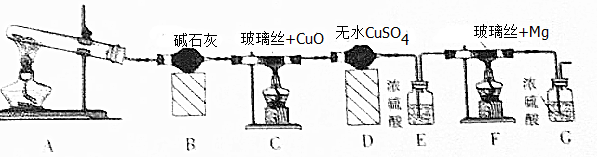
利用如图2装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集.
①E中收集到的气体可能是N2(填化学式).
②A、B、C中盛放的药品依次可以是Ⅱ(选填:I、Ⅱ、Ⅲ).
I.a、b、dⅡ.c、b、eⅢ.b、c、f
(5)过滤用到的主要玻璃仪器是玻璃棒、烧杯和漏斗.
分析 据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,过滤洗涤干燥就可以得到高氯酸铵的固体.
(1)根据题干信息:氯酸钠受热分解生成高氯酸钠和氯化钠来书写方程式;
(2)根据温度和物质的溶解度的关系知道:高氯酸钠的溶解度受温度影响大,但是氯化钠的溶解度受温度影响不大;
(3)向高氯酸钠中加入氯化铵,沉淀向着更难溶的物质转化;
(4)氯气能被NaOH吸收,水可以被浓硫酸吸收,氧气可以被热的Cu吸收,氮气可以用排水法收集,氢氧化钠中有水,先是吸收氯气,再是将水吸收,最后吸水的是氧气,所以A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,最后用排水法收集氮气,据此分析;
(5)过滤用到的主要玻璃仪器是玻璃棒、烧杯和漏斗.
解答 解:(1)根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,得到方程式为4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl,
故答案为:4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl;
(2)可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,但是氯化钠的溶解度受温度的影响不大,不会析出晶体,故答案为:NaClO4;
(3)反应器高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,即发生反应的离子方
程式为NH4++ClO4-=NH4ClO4,故答案为:NH4++ClO4-=NH4ClO4;
(4)氯气能被NaOH吸收,水可以被浓硫酸吸收,氧气可以被热的Cu吸收,氮气可以用排水法收集,氢氧化钠中有水,先是吸收氯气,再是将水吸收,最后吸水的是氧气,所以A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,最后用排水法收集氮气,
①E中收集到的气体只能是氮气,故答案为:N2;
②A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,故答案为:Ⅱ;
(5)过滤用到的主要玻璃仪器是玻璃棒、烧杯和漏斗,故答案为:玻璃棒、烧杯和漏斗.
点评 本题是一道物质的分离和提纯的实验方案设计题,考查学生分析和解决问题的能力,难度大.

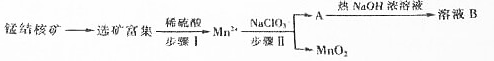
部分难容的电解质浓度积常数(Ksp)如下表:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1mol•L-1的NaClO3溶液200mL.该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是MnO2+H2O+e-═MnOOH+OH-.如果维持电流强度为5A,电池工作5分钟,理论消耗锌0.5g(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH,Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O.向所的溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色陈定成分为MnO2取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)用废旧电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中少量的杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2,其后果和原因是Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
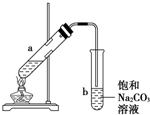 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
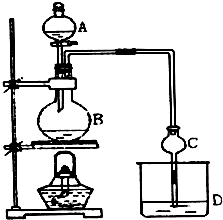 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.仔细观察溶液D中会有少量气泡产生,试用离子方程式解释产生此现象的原因是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:C2H5OH+2H2SO4→2C+2SO2↑+5H2O.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集77.1℃ 左右的馏分,以得较纯净的乙酸乙酯.
| A. | 明矾净水时使水中悬浮颗粒沉淀 | |
| B. | 清晨树林中的道道光柱 | |
| C. | 雾霾天气打手电能看到明显的光柱 | |
| D. | 澄清石灰水中通入CO2气体,有白色的沉淀 |