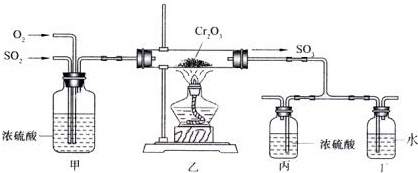
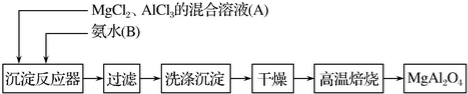
题目内容
3.硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂,聚合硫酸铁[Fe2(OH)n(SO4)(3-$\frac{n}{2}$)]m是高效的水处理混凝剂,在实验窒以铁屑和稀硫酸为主要原料.制备它们的实验方案如下;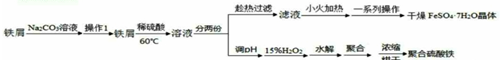
已知:所得聚合硫酸铁产品若能用于饮用水处理.需达到盐基度指际在8.0%~16.0%范围内.盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%
制备聚合硫酸铁的流程中,若溶液的pH调节过大,将导致聚合硫酸铁中铁的质量分数偏低(填“偏高”、“偏低”、“无影响”),加5%H2O2之前需取样分析溶液中离子的浓度,其目的是确定氧化Fe2+所需H2O2的量.
分析 用纯碱溶液洗铁屑表面的油污后加入稀硫酸、过滤得到滤液分两份.一份经小火加热等操作后得干燥硫酸亚铁晶体(FeSO4•7H2O).另一份在反应釜中加入氧化剂氧化亚铁离子为铁离子,加入水和硫酸生成聚合硫酸铁,减压蒸发得到聚合硫酸铁产品.
(1)pH偏大时铁离子易水解生成红褐色氢氧化铁胶体;
(2)取样分析溶液中离子的浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量.
解答 解:(1)铁离子易水解生成红褐色氢氧化铁胶体,聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则容易生成Fe(OH)3,将导致聚合硫酸铁中铁的质量分数偏低,
故答案为:偏低;
(2)取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量,
故答案为:确定氧化Fe2+所需H2O2的量.
点评 本题考查了物质组成探究、物质性质的分析、试剂选择,注意信息的分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
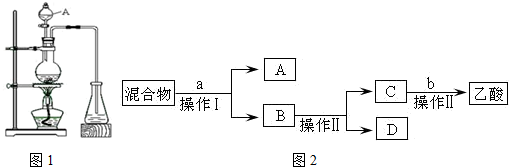
16.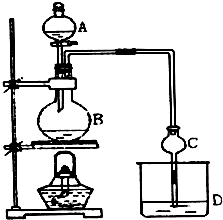 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
请回答:(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;仪器A的名称是分液漏斗;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.仔细观察溶液D中会有少量气泡产生,试用离子方程式解释产生此现象的原因是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:C2H5OH+2H2SO4→2C+2SO2↑+5H2O.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集77.1℃ 左右的馏分,以得较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.仔细观察溶液D中会有少量气泡产生,试用离子方程式解释产生此现象的原因是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:C2H5OH+2H2SO4→2C+2SO2↑+5H2O.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集77.1℃ 左右的馏分,以得较纯净的乙酸乙酯.
14.MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.其主要工艺如下:
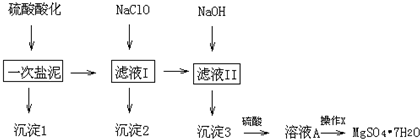
表:生成氢氧化物沉淀的PH
根据工艺流程和表1,请回答下列问题:
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是将盐泥中的碳酸盐和硅酸盐转化为可溶性的硫酸盐,同时生成硫酸钙和硅酸除去
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为Fe(OH)3、Al(OH)3;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为ClO-+Mn2++H2O=MnO2+Cl-+2H+
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是取滤液Ⅱ1-2ml于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+
(4)“操作X”是将溶液蒸发浓缩、冷凝结晶、过滤洗涤,即得到MgSO4•7H2O晶体.
(5)电解溶液A能否得到单质Mg不能(填“能”或“不能”),阳极反应式为2H2O-4e-=O2↑+4H+
(6)准确称量制得的样品5g,用200mL水溶解,加入2mol•L-1的盐酸5mL,在不断搅拌下滴加足量2mol•L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为98.4%.

表:生成氢氧化物沉淀的PH
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| Al(OH)3 | 3.7 | 5.7 |
| 开始溶解:7.8 | 完全溶解:10.0 |
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是将盐泥中的碳酸盐和硅酸盐转化为可溶性的硫酸盐,同时生成硫酸钙和硅酸除去
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为Fe(OH)3、Al(OH)3;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为ClO-+Mn2++H2O=MnO2+Cl-+2H+
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是取滤液Ⅱ1-2ml于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+
(4)“操作X”是将溶液蒸发浓缩、冷凝结晶、过滤洗涤,即得到MgSO4•7H2O晶体.
(5)电解溶液A能否得到单质Mg不能(填“能”或“不能”),阳极反应式为2H2O-4e-=O2↑+4H+
(6)准确称量制得的样品5g,用200mL水溶解,加入2mol•L-1的盐酸5mL,在不断搅拌下滴加足量2mol•L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为98.4%.
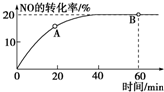 (1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.
(1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.