题目内容
7.20世纪70年代以后,由于对氢能源的研究和开发日趋重要,首先要解决氢气的安全贮存和运输问题,储氢材料和储氢技术是关键技术,是大家关注的热点之一.储氢材料范围由金属扩展至合金甚至有机物领域,根据信息材料请回答以下问题:(1)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiHⅡ.LiH+H2O=LiOH+H2↑
已知LiH固体密度为0.8g/cm3,用锂吸收11.2L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为$\frac{1}{1120}$.
(2)NaBH4(氢元素为-1价)也是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为NaBH4+2H2O═NaBO2+4H2↑.
(3)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下释放出氢气.在6.0mol•L-1HCl溶液中,混合物Y能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为52mol.
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
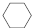 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$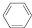 (g)+3H2(g).
(g)+3H2(g).在某温度下,向容积为2L的恒容密闭容器中加入环己烷,其起始物质的量为a mol,平衡时体系中压强为P MPa,苯的物质的量为b mol,平衡常数Kp=$\frac{27{b}^{4}{P}^{3}}{(a-b)(a+3b)^{3}}(MPa)^{3}$(用含a、b、P的代数式表示,平衡常数Kp表达式要求带单位;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).
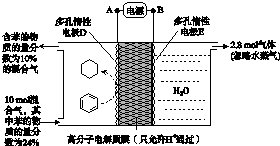
①导线中电流移动方向为B→E.(用B、E表示)
②生成目标产物的电极反应式为C6H6+6H++6e-═C6H12.
分析 (1)n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据方程式2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH知,0.5mol氢气参加反应生成1molLiH,m(LiH)=1mol×7g/mol=7g,V(LiH)=$\frac{m}{ρ}$;
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,还生成氢气,且反应前后B的化合价不变,可知H元素化合价由-1价、+1价变为0价,再结合转移电子守恒书写化学方程式;
(3)释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(4) (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)
开始(mol)a 0 0
反应(mol)b b 3b
平衡(mol)a-b b 3b
平衡时同一容器中各物质的压强之比等于其物质的量之比,所以环己烷的分压=$\frac{a-b}{a+3b}$PMpa,苯的分压=$\frac{b}{a+3b}$PMpa、氢气的分压=$\frac{3b}{a+3b}$PMpa,化学平衡常数Kp等于生成物浓度压强的幂之积与反应物分压的幂之积的比;
(5)①根据图知,D电极上苯生成环己烷,该电极上得电子发生还原反应,所以D为阴极、E为阳极,所以A是负极、B是正极,导线中电流从正极流向阳极;
②该实验目的是储氢,阴极上苯得电子和氢离子反应生成环己烷而储氢.
解答 解:(1)n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据方程式2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH知,0.5mol氢气参加反应生成1molLiH,m(LiH)=1mol×8g/mol=8g,V(LiH)=$\frac{m}{ρ}$=$\frac{8g}{0.8g/mL}$=0.01L,所以LiH与氢气的体积之比=0.01L:11.2L=$\frac{1}{1120}$,
故答案为:$\frac{1}{1120}$;
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,还生成氢气,且反应前后B的化合价不变,所以NaBH4与H2O中H元素发生归中反应,H元素化合价由-1价、+1价变为0价,依据得失电子守恒可知:NaBH4的系数为1,H2O的系数为2,依据原子个数守恒配平反应方程式:NaBH4+2H2O=NaBO2+4H2↑,
故答案为:NaBH4+2H2O=NaBO2+4H2↑;
(3)1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,
故答案为:52mol;
(4) (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)
开始(mol)a 0 0
反应(mol)b b 3b
平衡(mol)a-b b 3b
平衡时同一容器中各物质的压强之比等于其物质的量之比,所以环己烷的分压=$\frac{a-b}{a+3b}$PMpa,苯的分压=$\frac{b}{a+3b}$PMpa、氢气的分压=$\frac{3b}{a+3b}$PMpa,
化学平衡常数Kp=$\frac{(\frac{b}{a+3b}PMPa).(\frac{3b}{a+3b}PMPa)^{3}}{\frac{a-b}{a+3b}PMPa}$=$\frac{27{b}^{4}{P}^{3}}{(a-b)(a+3b)^{3}}(MPa)^{3}$,
故答案为:$\frac{27{b}^{4}{P}^{3}}{(a-b)(a+3b)^{3}}(MPa)^{3}$;
(5)①根据图知,D电极上苯生成环己烷,该电极上得电子发生还原反应,所以D为阴极、E为阳极,所以A是负极、B是正极,导线中电流从正极流向阳极,即电流从B流向E,故答案为:B→E;
②该实验目的是储氢,阴极上苯得电子和氢离子反应生成环己烷而储氢,电极反应式为C6H6+6H++6e-═C6H12,
故答案为:C6H6+6H++6e-═C6H12.
点评 本题考查较综合,涉及化学平衡计算、电解原理等知识点,侧重考查学生分析计算及知识迁移能力,把握化学反应原理是解本题关键,注意平衡常数Kp表达式的书写,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
部分难容的电解质浓度积常数(Ksp)如下表:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1mol•L-1的NaClO3溶液200mL.该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是MnO2+H2O+e-═MnOOH+OH-.如果维持电流强度为5A,电池工作5分钟,理论消耗锌0.5g(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH,Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O.向所的溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色陈定成分为MnO2取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)用废旧电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中少量的杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2,其后果和原因是Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
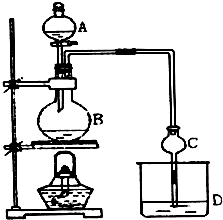 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.仔细观察溶液D中会有少量气泡产生,试用离子方程式解释产生此现象的原因是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:C2H5OH+2H2SO4→2C+2SO2↑+5H2O.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集77.1℃ 左右的馏分,以得较纯净的乙酸乙酯.
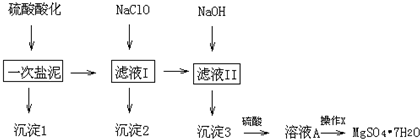
表:生成氢氧化物沉淀的PH
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| Al(OH)3 | 3.7 | 5.7 |
| 开始溶解:7.8 | 完全溶解:10.0 |
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是将盐泥中的碳酸盐和硅酸盐转化为可溶性的硫酸盐,同时生成硫酸钙和硅酸除去
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为Fe(OH)3、Al(OH)3;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为ClO-+Mn2++H2O=MnO2+Cl-+2H+
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是取滤液Ⅱ1-2ml于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+
(4)“操作X”是将溶液蒸发浓缩、冷凝结晶、过滤洗涤,即得到MgSO4•7H2O晶体.
(5)电解溶液A能否得到单质Mg不能(填“能”或“不能”),阳极反应式为2H2O-4e-=O2↑+4H+
(6)准确称量制得的样品5g,用200mL水溶解,加入2mol•L-1的盐酸5mL,在不断搅拌下滴加足量2mol•L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为98.4%.
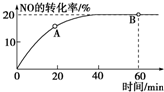 (1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.
(1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.