题目内容
3. 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ•mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol-1.
(2)实验室用Zn和稀硫酸制取H2,若向反应体系中加入少量下列试剂能加快产生H2速率的是D.
A.HNO3(浓)B.CH3COONa(固体)
C.Na2SO4 (固体) D.CuSO4(固体)
(3)有一种燃料电池,利用细菌将有机酸转化成氢气,氢气进入有氢氧化钾溶液的燃料电池中发电.电池负极反应式H2+2OH--2e-═2H2O.燃料电池与普通燃烧过程相比,优点是燃料电池的能量转化率远高于普通燃烧过程.
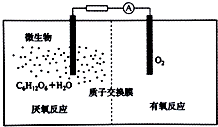
(4)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.请写出
①负极电极方程式C6H12O6-24e-+6H2O=6CO2+24H+.
②电池总反应方程式C6H12O6+6O2=6CO2+6H2O.
分析 (1)利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得CH4(g)+2H2O(g)═CO2(g)+4H2(g)的热化学方程式;
(2)依据影响化学反应速率因素分析判断增大反应速率的试剂,注意原电池反应的分析判断;
(3)燃料电池电极反应式书写,用总反应减去一个电极反应式就得另一个电极反应式;
(4)①根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
②该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol-1;
(2)若加入少量下列试剂中生成氢气反应速率增大,则
A.加入浓HNO3 溶液具有强氧化性,和锌反应不能生成氢气,故A不符合;
B.加入CH3COONa(固体)溶解后和稀硫酸反应生成醋酸属于弱酸,反应速率减小,故B不符合;
C.加入Na2SO4固体不影响反应的速率,故C不符合;
D.加入CuSO4 溶液,和锌反应生成铜,铜和锌在稀硫酸溶液中形成原电池反应,生成氢气速率增大,故D符合;
故答案为:D;
(3)这是氢氧燃料电池,负极发生氧化反应,是H2在反应,注意电解质溶液显碱性,H2得电子不能写出H+,因为其能和OH-反应,负极反应为H2+2OH--2e-═2H2O;
氢气燃烧本身无污染,但产生光能等,并且热能损耗较大,而氢氧燃料电池,是化学能直接转化为电能,无光能等产生,所以燃料电池的能量转化率高,
故答案为:H2+2OH--2e-═2H2O;燃料电池的能量转化率远高于普通燃烧过程;
(4)①根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故答案为:C6H12O6-24e-+6H2O=6 CO2+24H+;
②该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故答案为:C6H12O6+6O2=6CO2+6H2O.
点评 本题考查热化学方程式书写、化学电源新型电池,为高频考点,正确判断电解质溶液酸碱性是解本题关键,所有原电池中都是负极上失电子发生氧化反应、正极上得电子发生还原反应,难点是电极反应式的书写,主要涉及到盖斯定律、氧化还原、弱电解质的电离平衡的移动、燃料电池,题目难度中等.

| A. | 在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压力一定时,放热的熵增加反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程只与焓变有关 |
| 选项 | 实验方案 | 实验结果 |
| A | 将SO2气体依次通过NaHCO3溶液、溴水、品红溶液、澄清石灰水 | 品红无变化,澄清石灰水变浑浊 |
| B | 将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
| C | 取相同体积、相同物质的量浓度的NaHSO3与Na2CO3溶液,分别加入等体积、等浓度的少量盐酸 | 前者产生气体体积大于后者的 |
| D | 分别配置SO2和CO2的饱和溶液,立即测定两种饱和液的pH | 前者的pH小于后者的 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酒精与水 | B. | 汽油与植物油 | C. | 溴与四氯化碳 | D. | 水与四氯化碳 |
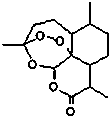 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X单质、Y单质工业上均用电解其氧化物法得来 | |
| B. | Z、W两元素形成的不同化合物,Z的化合价一定不同 | |
| C. | Y的氧化物能与酸反应也能与碱反应,所以既是酸性氧化物又是碱性氧化物 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
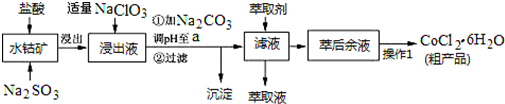
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
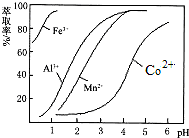
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
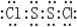 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl