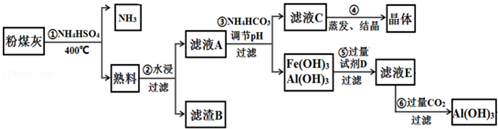
题目内容
18.某工厂的工业废水中含有大量的FeSO4 较多的Cu2+ 和少量的Na+ 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁及金属铜,请根据下列流程在标有①-⑤的方框和括号内填写物质名称或操作方法,完成回收硫酸亚铁及金属铜的简单实验方案.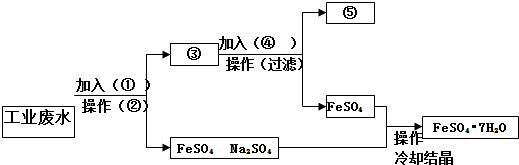
分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,先向混合液中加入过量Fe,然后过滤,则滤液中主要含硫酸亚铁、硫酸钠,再通过浓缩、蒸发结晶可以分离出硫酸亚铁;滤渣为Cu、Fe,向滤渣中加入H2SO4,通过过滤后可以分离出金属铜,以此解答该题.
解答 解:工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,①为Fe,操作②为过滤,③中含Cu、Fe,加入④为H2SO4,过滤,得到⑤为Cu,硫酸亚铁溶液经蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
故答案为:①铁粉; ②过滤; ③铁、铜;④硫酸;⑤铜.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,题目难度中等,把握实验流程中的试剂及发生的反应、混合物分离方法为解答的关键,侧重分析与推断能力的考查.

练习册系列答案
相关题目
8.反应:2H2(g)+O2(g)═2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
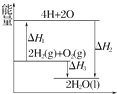

| A. | △H<0 | B. | △H2为该反应的反应热 | ||
| C. | △H3不是H2的燃烧热 | D. | △H3=△H1+△H3 |
9.短周期元素甲、乙、丙、丁的原子序数依次增大,甲形成的化合物种类最多,乙、丙、丁为同周期元素,其最高价氧化物对应的水化物两两之间能相互反应,丁的原子序数为甲、乙原子序数之和.下列说法正确的是( )
| A. | 元素丙的单质可用于冶炼金属 | |
| B. | 甲的氢化物比丁的氢化物热稳定性强 | |
| C. | 简单离子半径:乙>丁>丙 | |
| D. | 甲与乙的氧化物均有强氧化性 |
13.有K2SO4、Al2(SO4)3的混合溶液,已知其中的Al3+、SO42-的浓度分别为0.4mol/L、0.7mol/L,则该溶液中K+的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
7.已知钴(Co)的相对原子质量为59,一种钴的氧化物含+2价钴24.48%,+3价钴48.96%,则该钴的氧化物的化学式为( )
| A. | Co2O3 | B. | Co3O3 | C. | Co3O4 | D. | Co5O7 |
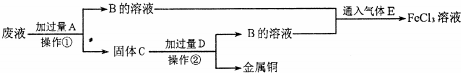
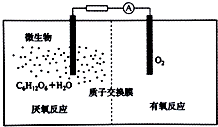 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.