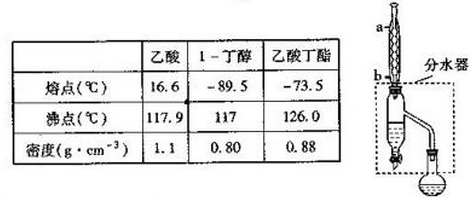
题目内容
1.下列离子方程式书写正确的是( )| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |
分析 A.氢离子、氢氧根离子的计量数错误,不满足硫酸、氢氧化钡的化学式组成;
B.二氧化碳过量,反应生成碳酸氢根离子;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.稀硝酸具有强氧化性,锌与稀硝酸反应生成的是NO气体.
解答 解:A.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.过量CO2通入NaOH溶液中,反应生成碳酸氢钠,反应的离子方程式为:CO2+OH-=H CO3-,故B正确;
C.硝酸银溶液中加入铜粉,二者发生置换反应,正确的离子方程式为:2Ag++Cu═Cu2++2Ag,故C错误;
D.锌与稀硝酸反应生成NO气体,正确的离子方程式为:3Zn+2NO3-+8H+=2NO↑+3Zn2++4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
11.气相直接水合法制乙醇的方程式为:C2H4 (g)+H2O(g)═C2H5OH(g),其中乙烯的平衡转化率与温度、压强的关系如图[起始n(H2O):n(C2H4)=1:1.

计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)( )

计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)( )
| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
12.下列说法不正确的是( )
| A. | 钠、钾着火时,不能用泡沫灭火器灭火 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| D. | 在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量 |
9.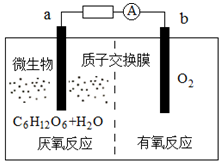 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
16.实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,以下说法正确的是( )
| A. | 称取8.0g硫酸铜,加入500mL水 | |
| B. | 称取12.0g胆矾配成500mL溶液 | |
| C. | 定容摇匀后液面下降,应加水至凹液面最低点与刻线相平 | |
| D. | 定容时仰视刻线会使所配溶液浓度偏小 |
20.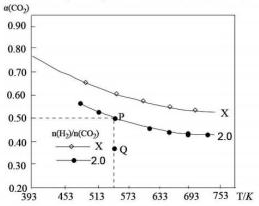 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 若起始时,CO2、H2、浓度分分别为0.5mol/L和1.0mol/L,则可得P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
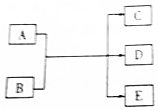 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.