题目内容
11.气相直接水合法制乙醇的方程式为:C2H4 (g)+H2O(g)═C2H5OH(g),其中乙烯的平衡转化率与温度、压强的关系如图[起始n(H2O):n(C2H4)=1:1.
计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)( )
| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
分析 由图可知,A点乙烯的平衡转化率为20%,设起始量n(H2O)=n(C2H4)=1mol,转化的乙烯为0.2mol,则:
C2H4(g)+H2O(g)═C2H5OH(g)
起始量(mol):1 1 0
转化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.8 0.2
压强之比等于物质的量之比,计算乙烯、水蒸气、乙醇蒸气分压,再根据Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})×p({H}_{2}O)}$计算.
解答 解:由图可知,A点乙烯的平衡转化率为20%,设起始量n(H2O)=n(C2H4)=1mol,转化的乙烯为0.2mol,则:
C2H4(g)+H2O(g)═C2H5OH(g)
起始量(mol):1 1 0
转化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.8 0.2
压强之比等于物质的量之比,则p(C2H4)=p(H2O)=7.8MPa×$\frac{0.8mol}{1.8mol}$=7.8MPa×$\frac{4}{9}$,p(C2H5OH)=7.8MPa×$\frac{1}{9}$,则Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})×p({H}_{2}O)}$=$\frac{7.8MPa×\frac{1}{9}}{7.8MPa×\frac{4}{9}×7.8MPa×\frac{4}{9}}$=0.072MPa-1,
故选C.
点评 本题考查化学平衡计算,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及平衡常数计算,答题关键是计算各组分反应,注意平衡常数单位问题,难度不大.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: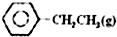 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$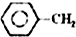 =CH2(g)+H2(g)
=CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
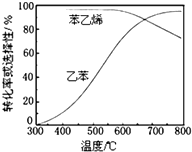
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
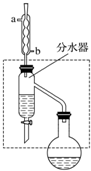 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是C(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
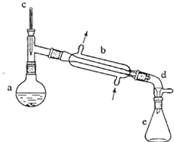 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: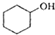 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$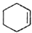 +H2O
+H2O可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90oC.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需初加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前必须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.环形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
| A. | 元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | Li是最活泼金属,F是最活泼非金属 | |
| D. | NaOH碱性比KOH强 |
| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |