题目内容
16.实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,以下说法正确的是( )| A. | 称取8.0g硫酸铜,加入500mL水 | |
| B. | 称取12.0g胆矾配成500mL溶液 | |
| C. | 定容摇匀后液面下降,应加水至凹液面最低点与刻线相平 | |
| D. | 定容时仰视刻线会使所配溶液浓度偏小 |
分析 实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,实验室没有480mL容量瓶,应选择500mL规格容量瓶,配制500mL溶液,依据m=CVM计算需要硫酸铜、五水硫酸铜的质量,注意物质的量浓度中体积为溶液的体积,分析操作对溶质的物质的量的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,实验室没有480mL容量瓶,应选择500mL规格容量瓶,配制500mL溶液,需要硫酸铜的质量为:0.1mol/L×160g/mol×0.5L=8.0g,需要五水硫酸铜的质量:0.1mol/L×250g/mol×0.5L=12.5g,
A.称取8.0g硫酸铜,加入500mL水,溶液体积大于500mL,故A错误;
B.称取12.0g胆矾配成500mL溶液,称取溶质的质量偏小,溶液浓度偏小,故B 错误;
C.定容摇匀后液面下降,应加水至凹液面最低点与刻线相平,导致溶液体积偏大,溶液浓度偏小,故C错误;
D.定容时仰视刻线,导致溶液体积偏大,则所配溶液浓度偏小,故D正确;
故选:D.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法,注意溶液体积与溶剂体积的关系.

练习册系列答案
相关题目
4.某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(g).“?“代表状态不确定.反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
11.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+和Na+.某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是( )


| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |
1.下列离子方程式书写正确的是( )
| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |
8.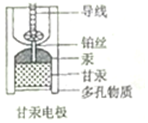 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
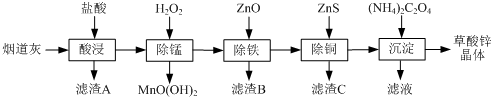
15.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中.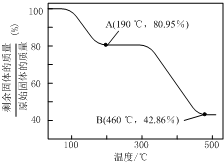
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如右图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中.

(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如右图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
16.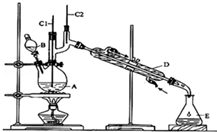 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
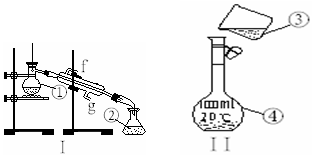 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.