题目内容
3.Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,将2mol碘化氢气体充入体积为VL的容器中进行分解,当反应达到平衡时气体混合物中碘化氢的体积分数为0.80,试计算:(1)该反应的平衡常数K(计算结果用分数表示).
(2)达平衡时HI的转化率.
分析 达到平衡时,气体混合物中碘化氢的体积分数为0.80,根据反应2HI(g)?H2(g)+I2(g)可知,反应前后气体的物质的量不变,则平衡时HI的物质的量为2mol×0.80=1.6mol,则
2HI(g)?H2(g)+I2(g)
起始时(mol) 2 0 0
转化(mol•) 0.4 0.2 0.2
平衡时(mol) 1.6 0.2 0.2
(1)根据c=$\frac{n}{V}$计算出平衡时各组分的浓度,平衡常数K为生成物浓度幂之积与反应物浓度幂之积的比,然后据此计算出该反应的平衡常数;
(2)根据转化率=$\frac{消耗量}{起始量}$×100%计算出平衡时HI的转化率.
解答 解:达到平衡时,气体混合物中碘化氢的体积分数为0.80,根据反应2HI(g)?H2(g)+I2(g)可知,反应前后气体的物质的量不变,则平衡时HI的物质的量为2mol×0.80=1.6mol,则
2HI(g)?H2(g)+I2(g)
起始时(mol) 2 0 0
转化(mol•) 0.4 0.2 0.2
平衡时(mol) 1.6 0.2 0.2
(1)该反应在716K时时的平衡常数为:K=$\frac{\frac{0.2mol}{VL}×\frac{0.2mol}{VL}}{(\frac{1.6mol}{VL})^{2}}$=$\frac{1}{64}$,
答:该反应在716K时时的平衡常数为$\frac{1}{64}$;
(2)达平衡时HI的转化率为:$\frac{0.4mol}{2mol}$×100%=20%,
答:达平衡时HI的转化率为20%.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

 备战中考寒假系列答案
备战中考寒假系列答案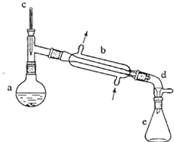 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: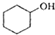 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$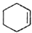 +H2O
+H2O可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90oC.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需初加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前必须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.环形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |
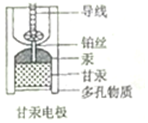 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |
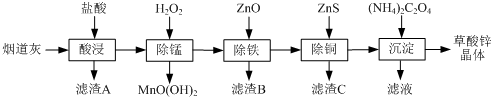
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中.
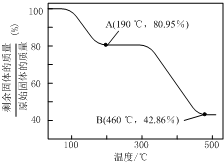
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如右图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
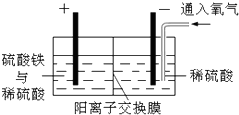 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: