题目内容
9.某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是Fe3+、Cl-,若要用实验证明该阴离子是否存在,最可靠的化学方法是取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl-,否则Cl-不存在.
(2)气体F遇氯气产生白烟,写出此反应的化学方程式8NH3+3Cl2=6 NH4Cl+N2.
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0mL时开始产生沉淀,55mL时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60mL时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为0.15mol/L、c(Fe3+)为0.1mol/L、c(Cl-)为0.4mol/L.(若有些离子不存在,请填0mol/L)
分析 在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答 解:强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C9.32g为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量为$\frac{9.32g}{233g/mol}$=0.04mol,浓度是$\frac{0.04mol}{0.1L}$=0.4mol/L,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,112mL氨气的物质的量是0.005mol,根据氮元素守恒,溶液中含有NH4+离子物质的量是0.005mol,浓度是0.05mol/L;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl-;检验氯离子的方法为:取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl-,否则Cl-不存在,
故答案为:Fe3+、Cl-;取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl-,否则Cl-不存在;
(2)F为NH3,氨气与氯气发生反应生成氯化铵和氮气,反应的化学方程式为:8NH3+3Cl2=6 NH4Cl+N2,
故答案为:8NH3+3Cl2=6 NH4Cl+N2;
(3)根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,得到112mL0.005molNO,Fe2+的物质的量是0.015mol,所以原溶液中c(Fe2+)=$\frac{0.015mol}{0.1L}$=0.15mol/L,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,所以Fe3+的物质的量是0.01mol,所以原溶液中c(Fe3+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,硫酸根离子的物质的量为$\frac{9.32g}{0.1L}$=0.04mol,浓度是$\frac{0.04mol}{0.1L}$=0.4mol/L;NH4+离子物质的量是0.005mol,浓度是0.05mol/L,Al3+的物质的量是0.005mol,浓度是0.05mol/L,
根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知参加反应H+为0.005mol×4=0.02mol,加入氢氧化钠消耗H+为0.01L×2mol/L=0.02mol,故原溶液中H+为0.02mol+0.02mol=0.04mol,由于2c(Fe2+)+3c(Fe3+)+3c(Al3+)+c(NH4+)=(2×0.15+3×0.1+3×0.05+0.05)mol/L=0.8mol/L,2c(SO42-)=0.8mol/L,原溶液中含有Cl-,根据电荷守恒:c(Cl-)=c(H+)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:0.15; 0.1;0.4.
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,(3)为难点、易错点,注意溶液电中性知识在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中,当转移0.2mol电子时,有0.1mol的Fe2+被氧化 | |
| D. | 实验③中反应的离子方程式为:Fe+Fe3+═2Fe2+ |
| A. |  | B. |  | C. |  | D. |  |
| A. | CH2O | B. | C2H4O | C. | C2H4O2 | D. | C3H8O |
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
| A. | 苯分子的结构中六个碳原子的连接方式是单双建交替组成的环状 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
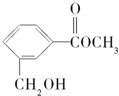
| A. | 有机物M中有2种含氧官能团 | |
| B. | 1mol有机物M可与1mol NaOH发生反应 | |
| C. | 有机物M能与溴水发生加成反应 | |
| D. | 1mol有机物M最多能与3mol H2反应 |