题目内容
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
分析 Na2O2具有强氧化性,可与还原性物质发生氧化还原反应,可与水反应生成NaOH,反应后溶液呈碱性,可与HCO3-反应,据此进行解答.
解答 解:Na2O2具有强氧化性,与SO32-发生氧化还原反应,则SO32-浓度减小,
Na2O2与水反应生成NaOH,反应后溶液呈碱性,可与HCO3-反应生成CO32-,则HCO3-浓度减小,CO32-浓度增大,
所以浓度基本不变的是NO3-,
故选C.
点评 本题考查过氧化钠的性质,题目难度不大,注意过氧化钠的强氧化性以及与水反应的产物,试题侧重基础知识考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.已知短周期元素的离子,A2+、B+、C2-、D-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
12.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| B. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 常温下,5.6g Fe片投入到足量的浓硝酸中,转移电子数为0.3NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA |
16.下列叙述正确的是( )
| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |
19.实验探究是体验知识的产生和形成过程的基本途径.某化学兴趣小组为探究元素性质递变规律,设计了如下实验:
试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
| 实验方案(只要求填写选用试剂) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 实验现象 | 针对方程式①②或③试管中先生成白色沉淀,后白色沉淀消失. 针对方程式④:试管中有白色沉淀. | 溶液由浅黄绿色变成橙黄色 |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |

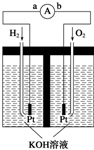 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: