题目内容
17.某有机物M的蒸气与相同状况下同体积氧气的质量比是30,其分子中碳、氢的质量分数分别是40%、6.6%,其余为氧.有机物M的分子式为( )| A. | CH2O | B. | C2H4O | C. | C2H4O2 | D. | C3H8O |
分析 某有机物A的蒸气与相同状况下同体积氢气的质量比是30,则相对分子质量为60,其分子中碳、氢的质量分数分别是40%、6.6%,其余为氧,可知结合治理分数计算原子个数,从而确定有机物的分子式,以此解答该题.
解答 解:某有机物A的蒸气与相同状况下同体积氢气的质量比是30,则相对分子质量为60,其分子中碳、氢的质量分数分别是40%、6.6%,其余为氧,可知有机物中N(C)=$\frac{60×40%}{12}$=2,N(H)=$\frac{60×6.6%}{12}$=4,N(O)=$\frac{60×(1-40%-6.6%)}{16}$=2,则分子式为C2H4O2,
故选C.
点评 本题考查有机物分子式计算的确定,为高频考点,把握相对分子质量、分子中原子个数等为解答的关键,侧重分析与计算能力的考查,注意分子式的确定方法,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
7.以下化学用语中,正确的是( )
| A. | 乙炔分子的结构式:H-C≡C-H | B. | 苯的结构简式: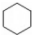 | ||
| C. | 乙醛分子的结构简式:CH3COH | D. | 甲烷分子的比例模型: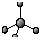 |
5.在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
| A. | HOOCCOOH | B. | HOCH2CH2CH2COOH | C. | HOCH2CH2OH | D. | CH3COOH |
12.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| B. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 常温下,5.6g Fe片投入到足量的浓硝酸中,转移电子数为0.3NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA |
2.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、A13+、Ba2+、Fe2+、NO3-、SO42-、Cl-、I-、HCO3-.取该溶液实验如下:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和 浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
7.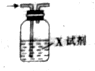 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )| A. | NaOH溶液 | B. | 浓硫酸 | C. | Na2CO3溶液 | D. | NaHCO3溶液 |
