题目内容
14.下列关于苯的叙述中正确的是( )| A. | 苯分子的结构中六个碳原子的连接方式是单双建交替组成的环状 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
分析 A.苯中的化学键是一种特殊的键,六个碳碳键完全等同是一个大π键;
B.苯分子中无碳碳双键;
C.苯中的化学键是一个大π键,所以6个碳碳化学键完全相同;
D.苯可以与溴水发生萃取褪色,但不发生反应,和高锰酸钾溶液不反应;
解答 解:A.苯中的化学键是一个大π键,它既不同于碳碳单键也不同于碳碳双键,是六个碳碳键完全等同的环状结构,故A错误;
B.苯分子中6个碳碳化学键完全相同,不存在碳碳双键,不是烯烃,故B错误;
C.苯中的化学键是一个大π键,它既不同于碳碳单键也不同于碳碳双键,苯分子中6个碳碳化学键完全相同,故C正确;
D.苯中的化学键是一个大π键,它没有碳碳单键和碳碳双键,所以和溴水、酸性高锰酸钾不反应,故D错误;
故选C.
点评 本题考查了苯的结构和性质,难度不大,注意苯中的化学键是既不同于碳碳单键也不同于碳碳双键的大π键.

练习册系列答案
相关题目
5.在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
| A. | HOOCCOOH | B. | HOCH2CH2CH2COOH | C. | HOCH2CH2OH | D. | CH3COOH |
2.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、A13+、Ba2+、Fe2+、NO3-、SO42-、Cl-、I-、HCO3-.取该溶液实验如下:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和 浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
19.不能用来鉴别K2CO3和KHCO3两种白色固体的实验操作是( )
| A. | 分别在这两种物质的溶液中,加入BaCl2溶液 | |
| B. | 分别在这两种物质的溶液中,加入少量澄清的石灰水 | |
| C. | 分别在这两种固体中,加入同浓度的稀盐酸 | |
| D. | 分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中 |
12.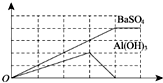 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )| A. | Q为NH4Al(SO4)2,P为Ba(OH)2 | B. | Q为Ba(OH)2,P为明矾 | ||
| C. | Q为明矾,P为Ba(OH)2 | D. | Q为Ba(AlO2)2,P为硫酸铝 |
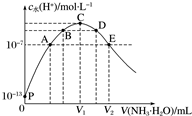 常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.
常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.